Cuando pone sus huevos, la especie invasora Drosophila suzukii perfora y destruye las cerezas, arruinando las cosechas. Una asociación de agricultores de EE. UU. está financiando esta técnica de edición genética para acabar con ella, si los opositores no le frenan
Desde que hizo su primera aparición al norte de California (EE. UU.) en 2008, la mosca del vinagre de alas manchadas (Drosophila suzukii), un tipo de mosca de la fruta invasora, nativa de Asia, está arruinando las cosechas de cerezos del estado debido al afilado ovipositor de su cola.
Este órgano sirve a las hembras para depositar sus huevos, pero en lugar de hacerlo sobre bayas podridas como hacen las moscas domésticas, esta especie perfora agujeros en la fruta que aún está madurando, estropeándola. Los costes para la agricultura se acercan a los 600 millones de euros al año sólo en Estados Unidos.
Los productores de cerezas de California plantean un método de bajo coste para deshacerse de las moscas de alas manchadas. Se trata de una tecnología desarrollada por expertos en genética: los "genes dirigidos", que pueden diseminar alteraciones del ADN entre las moscas silvestres, algo que tiene potencial para matarlas (ver Genes dirigidos, ¿la solución contra la malaria o los asesinos de la naturaleza?).
La tecnología de genes dirigidos figuran entre los inventos más debatidos y temidos de la biología moderna (ver Las siete tecnologías prohibidas sobre las que nadie quiere hablar). Los opositores la califican de "bomba atómica" genética y quieren que sea prohibida. Otros valoran la posibilidad de realizar intervenciones de salud pública sin precedentes, como la erradicación de los mosquitos que propagan la malaria (ver Los mosquitos condenados a morir para erradicar la malaria ya están aquí).
Ahora, por primera vez, los usos comerciales de esta tecnología están sobre la mesa. Con fondos del Consejo de Cerezas de California, unos científicos de la Universidad de California en Riverside (EEUU) han introducido genes dirigidos en la plaga invasora, la primera vez que la tecnología se ha aplicado a una especie comercialmente importante.
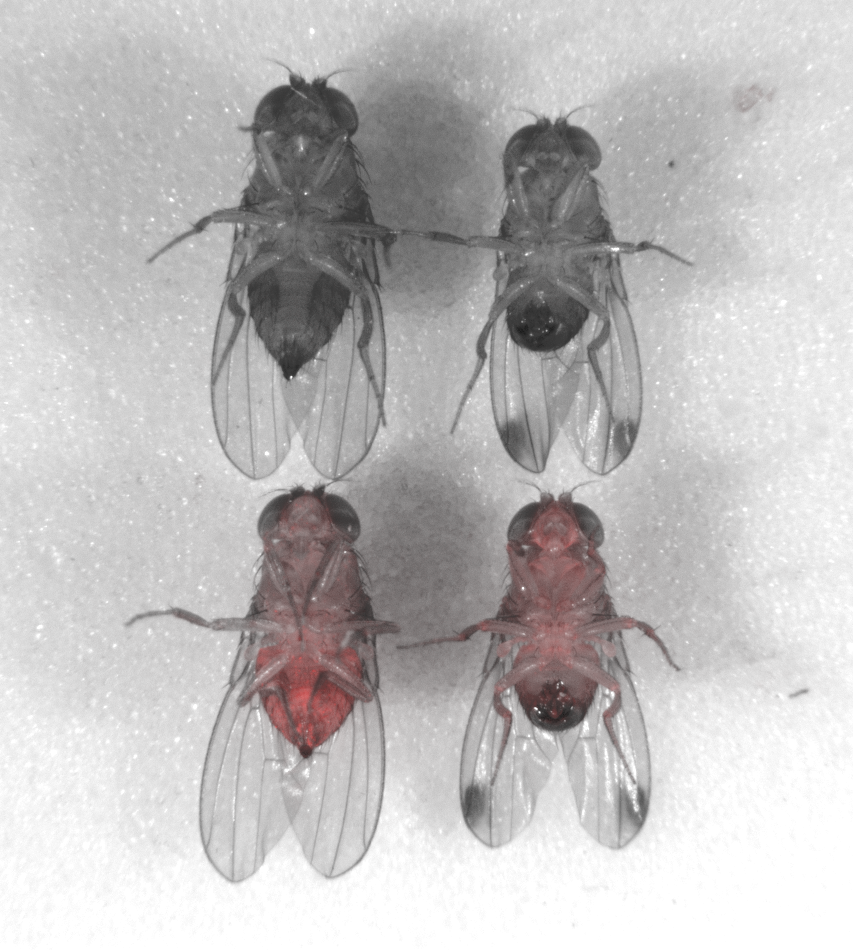
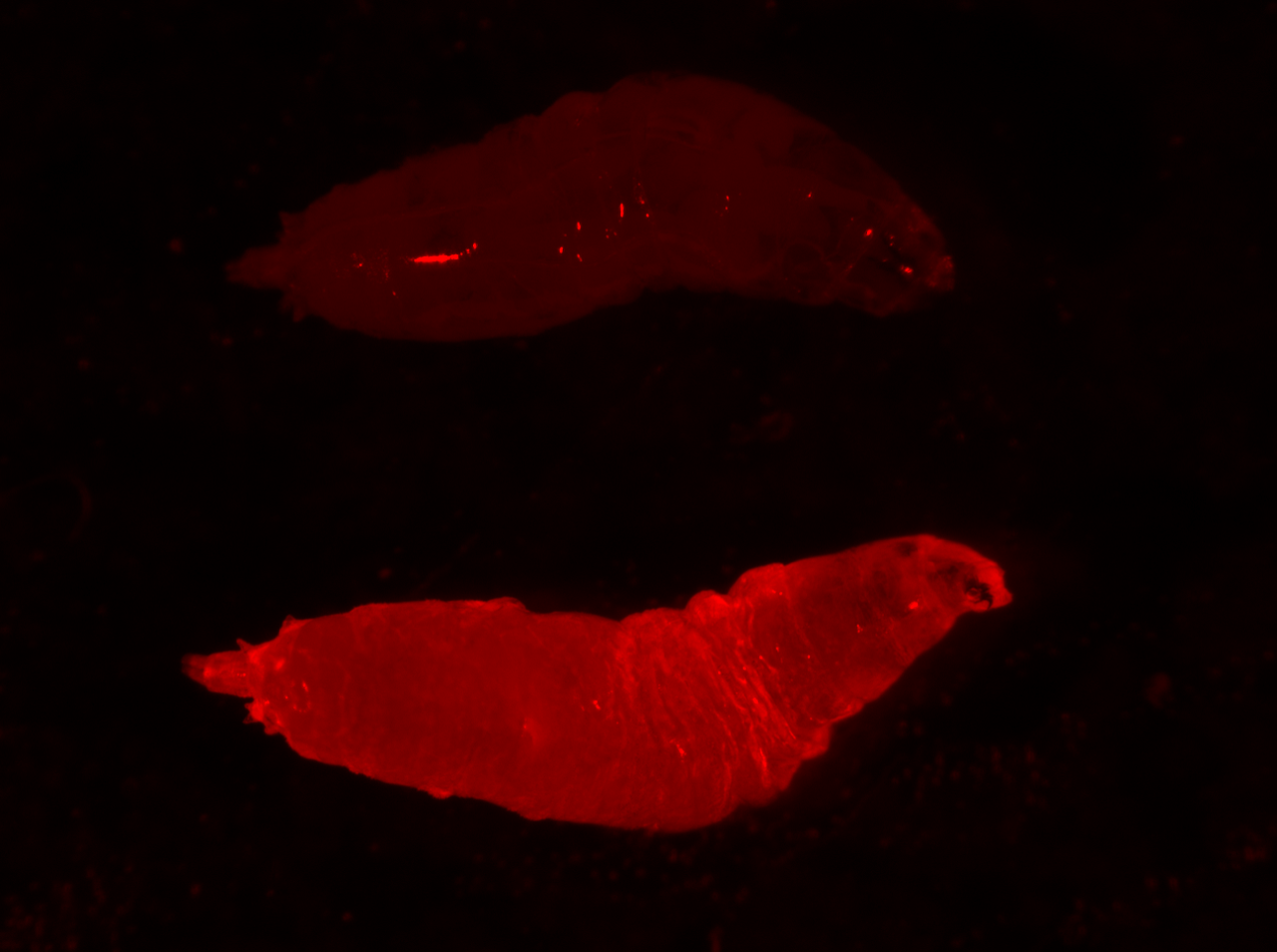 Foto: La larva de una mosca de la fruta se ilumina en rojo. La marca fluorescente indica que ha heredado un "gen dirigido", o ADN egoísta, de su madre.
Foto: La larva de una mosca de la fruta se ilumina en rojo. La marca fluorescente indica que ha heredado un "gen dirigido", o ADN egoísta, de su madre.
Además de ese esfuerzo, que permanece confinado en el laboratorio, dos compañías de la Universidad de California en San Diego (EEUU) también están buscando usos comerciales de genes dirigidos. Una de ellas, Agragene, también tiene intención de alterar plantas e insectos. Su compañía hermana, Synbal, quiere aprovechar la tecnología como una forma rápida de diseñar ratones de laboratorio y posiblemente perros domésticos.
"Se trata de tener los genes bajo un control preciso en cualquier organismo que se modifique", explica el CEO en funciones de ambas spin-offs de la Universidad de California en San Diego, David Webb. Eso sí, de momento ninguna ha recaudado capital.
Los genes dirigidos funcionan mediante un llamado gen egoísta capaz de replicarse y ser heredado por la mayoría de los descendientes de un animal en lugar de la mitad de ellos, como es habitual. El efecto se llama herencia "supermendeliana".
El problema es que la modificación de animales salvajes plantea complejas cuestiones éticas y regulatorias. Algunos científicos temen que los genes dirigidos se descontrolen si escapan de los animales modificados del laboratorio, lo que haría que los cambios se propagaran por la naturaleza (ver Un científico se alza contra el secretismo y los riesgos de los genes dirigidos). El Instituto Broad del Instituto Tecnológico de Massachusetts (MIT) y la Universidad de Harvard (ambos en EE. UU.) incluso han añadido los genes dirigidos a la lista de usos de la edición génica que las empresas no deberían investigar.
Además, cualquier uso de una tecnología tan poderosa estará muy regulado. Tales obstáculos explican por qué la mayoría de financiación de estos proyectos proviene de filántropos o las fuerzas armadas. La Fundación Gates ha destinado unos 64 millones de euros a la ingeniería de mosquitos autodestructivos, que cree que pueden ser necesarios para eliminar la malaria en África (ver El día que el hombre aprendió a extinguir especies para resolver sus problemas). Este año, la agencia de investigación militar estadounidense DARPA empezó a invertir una cantidad similar en el desarrollo de antídotos para los genes dirigidos, en caso de que empiecen a usarse como armas.
El Consejo de Cerezas de California, que representa a los productores, solo quiere deshacerse de las moscas. Cuando la plaga apareció hace una década, los agricultores empezaron a rociar insecticidas llamados piretroides con nombres comerciales como Delegate y Warrior.

Foto: Omar Akbari.
"Este es básicamente el producto químico más fuerte que existe", afirma el ejecutivo de la organización de productores Nick Matteis. Los aerosoles matan a las moscas y casi todos los demás insectos, incluidas las abejas. "Si no hiciera falta rociar, sería un gran avance", asegura.
Para los productores de cerezas, los genes dirigidos parecen una herramienta precisa que podría eliminar una especie entre miles. En 2013, la organización empezó a financiar el desarrollo de la tecnología, con una inversión anual de alrededor de unos 85.000 euros, o aproximadamente un tercio de su presupuesto de investigación, para que el profesor de la Universidad de California en Riverside Omar Akbari instale genes dirigidos en el genoma de esa mosca.
El investigador, experto en genética de insectos y uno de los participantes en el programa de DARPA, afirma: "desde su perspectiva puede parecer mucho dinero, pero desde la nuestra, solo da para pagar un salario y algunos experimentos".
Aun así, en julio, Akbari cosechó un éxito con los genes dirigidos. Su tecnología, llamada Medea en honor a la hechicera griega que asesinó a sus hijos, se extendió al 100% de las moscas en experimentos en jaulas de laboratorio, dice. El siguiente paso consiste en determinar qué alteración genética unir al gen egoísta. Las moscas hembras sobreviven el invierno porque sus cuerpos producen crioprotectores. Añadir un gen para bloquear esas sustancias químicas podría hacer que las moscas se congelen. Otra posibilidad consiste en alterar genéticamente el ovipositor de los insectos para que cambien su comportamiento.
El investigador detalla: "Si nos deshiciéramos de ese cuchillo o lo bloqueáramos, en lugar de apuñalar cerezas maduras pondrían sus huevos en la fruta podrida, como las moscas normales. Las moscas seguirían existiendo, pero ya no representarían una plaga para los cultivos".
La gente teme que los genes dirigidos se vuelvan imparables una vez liberados. De hecho, los científicos tienen bastantes trucos para mantenerlos bajo control. En el caso de Akbari, su sistema Medea requiere una gran cantidad de insectos para catalizar una reacción en cadena, al menos miles. Eso significa que es poco probable que unas pocas moscas que se escapen a bordo de una caja de cerezas tendrían pocas probabilidades de propagar los genes dirigidos accidentalmente.
El Consejo de Cerezas de California afirma estar dispuesto a financiar estudios de laboratorio a gran escala. Para pagarlos y finalmente buscar la aprobación para implementar genes dirigidos fuera del laboratorio, el grupo de agricultores planea recaudar fondos de otros productores de frutas para financiar una "corporación de beneficio público". La compañía tendría, como parte de su carta orgánica, la obligación de mantener sus planes técnicos y finanzas al descubierto.
El asesor de los agricultores en la formación de la nueva empresa Tom Turpen explica: "crearemos una entidad que básicamente se dedicará al negocio de fideicomisos". De lo contrario, dice, los opositores de los organismos modificados genéticamente (OMG) probablemente instigarían un paralizante debate público.
Matteis, el ejecutivo del Consejo de Cerezas de California, dice que tiene la esperanza de que el público respalde el plan. El responsable concluye: "[con] cualquier insecto considerado remotamente beneficioso para el medio ambiente, resultaría mucho más difícil. Pero este insecto es un recién llegado. Habría menos preocupaciones sobre interrumpir el ciclo de la vida".


