Biotecnología
Los embriones sintéticos encienden el nuevo debate sobre los límites de la vida y la ciencia
Aunque los embrioides carecen de muchas células clave necesarias para formar a una persona, la polémica en torno a ellos es cada vez mayor. Sus defensores consideran que es una tecnología emergente que podría revolucionar la medicina y el conocimiento humano
Yue Shao nunca había visto nada parecido. Hace dos años, este ingeniero mecánico con talento para la biología estaba trabajando con células madre embrionarias, esas que proceden de un embrión humano y que son capaces de convertirse en cualquier tipo de célula. Mientras experimentaba con distintos procesos para conseguir que las células formasen estructuras tridimensionales más organizadas al cultivarlas en matrices de gel suave, buscaba indicios de tejido nervioso primitivo.
Lo que llamó su atención fue que las células parecían cambiar mucho más rápido de lo esperado; en sólo unos pocos días, ellas solas se colocaron en forma de círculo desigual.
¿Qué estaba pasando? Shao empezó a buscar en Google para ver si podía identificar la estructura. Fue entonces cuando llegó a un sitio web llamado El Embrión Humano Virtual y encontró algunas fotos al microscopio de embriones humanos poco después de la implantación, enganchados a la pared uterina. Ahí estaba el comienzo del saco amniótico y, dentro de él, el disco embrionario o futuro cuerpo. Era igual que lo que estaba viendo en sus células.
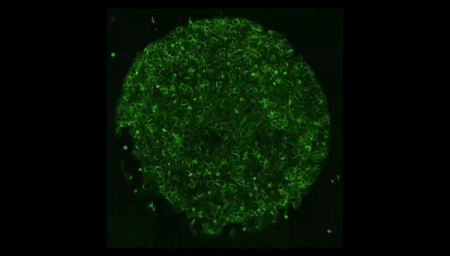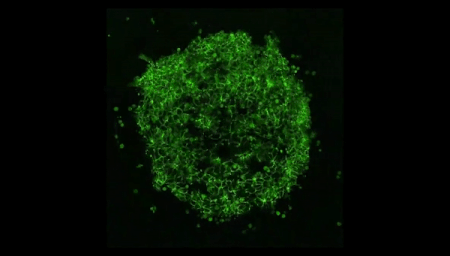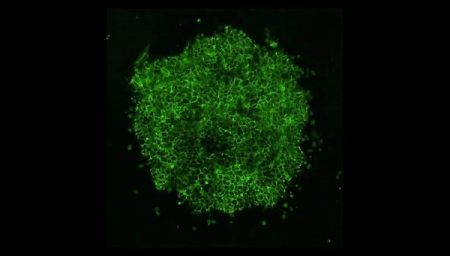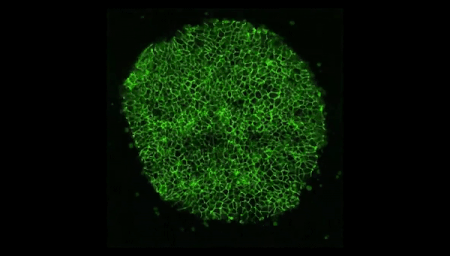
Vídeo: En esta película hecha al microscopio, filmada durante cuatro días, las células madre se autoorganizan en formas que imitan a un embrión humano. Crédito: Cortesía de la Universidad de Míchigan.
Shao informó a sus compañeros, un equipo mixto de biólogos e ingenieros, en la Universidad de Míchigan (EEUU). El investigador recuerda: "Cuando le mostré la imagen al equipo, todos dijeron: '¡Guau!, tenemos que averiguar qué hacer'". ¿Habían fabricado, sin saberlo, un verdadero embrión humano a partir de células madre? "A partir de ese momento, empezamos a ser más cautelosos", detalla.
El equipo no tardó en descubrir que sus estructuras parecidas a embriones no estaban completas y no podrían convertirse en una persona. Carecían de los tipos de células necesarios para hacer una placenta, un corazón o un cerebro. Aun así, los "embrioides" de Míchigan son tan realistas que el laboratorio los destruye pasados cinco días para asegurarse de que no se desarrollan más.
El trabajo forma parte de una tendencia al alza para estudiar los organoides. Los científicos utilizan células madre para crear agregados de células que cada vez se parecen más a pedazos de cerebro, pulmones o intestino (ver 10 Tecnologías Emergentes 2015: Organoides cerebrales para desentrañar la mente). Ahora algunos como Shao creen que es posible imitar al propio embrión. Este año, por ejemplo, investigadores en Cambridge (Reino Unido) construyeron una réplica convincente de un embrión de ratón de seis días al combinar dos tipos de células madre. Ahora, ese grupo de investigación está intentando hacer lo mismo con células humanas, igual que otro equipo de la Universidad Rockefeller en Nueva York (EEUU). Según los científicos, está emergiendo una nueva tecnología, a la que llaman "embriología sintética", que podría permitirles investigar en detalle por primera vez los fascinantes primeros capítulos del desarrollo humano.
Hasta ahora ha sido muy difícil acceder a estas fases de la evolución humana. Los embriones de investigación no pueden crecer más de una semana, y lo que sucede después de ese tiempo en la naturaleza tiene lugar en la oscuridad del útero humano incluso antes de que la mayoría de las mujeres sepan que están embarazadas.
Es más, la investigación con embriones humanos reales suele chocar con las políticas sobre el aborto y estar limitada por las leyes de financiación y los suministros procedentes de las clínicas de fecundación in vitro. Pero el cultivo de embrioides podría saltarse esas barreras. Ya están desplegando todo el conjunto de modernas herramientas de laboratorio (edición de genes, optogenética, microscopios de alta velocidad) para poder repetir el experimento cientos de veces o, con magia genética, hacer mil preguntas a la vez.
El equipo de Michigan ya tiene un resultado: un vídeo de células madre que se autoorganizan en estructuras que asemejan embriones. "Es increíble que [las células madre] tengan esta capacidad", dice el profesor de la Universidad de Míchigan Jianping Fu, en cuyo laboratorio de ingeniería estudió Shao. Para el experto, la aparición de algo con la forma de un embrión, y algunas de sus características, fue "una completa sorpresa". Fu afirma: "Todavía no puedo creerlo. Pero demuestra que estas células recuerdan lo que se supone que deben hacer".
Los científicos de Michigan esperan fabricar embrioides por centenares. Podrían utilizarse para examinar qué sustancias causan anomalías congénitas, encontrar otras para aumentar las posibilidades de embarazo, o para crear material de partida para los órganos de laboratorio. Pero las disputas éticas y políticas pueden no estar muy lejos. "Es una nueva y candente frontera en la ciencia y la bioética. Y parece que la polémica durará unos cuantos años", advierte el miembro de la unidad de bioética de la Universidad McGill, en Montreal (Canadá) Jonathan Kimmelman, que lidera una organización internacional de científicos de células madre.
¿Qué es lo que realmente está creciendo en la placa? La respuesta no es fácil. De hecho, nadie está seguro de cómo llamar a estas nuevas entidades. En marzo, un equipo de la Universidad de Harvard (EEUU) propuso "entidades sintéticas humanas con características embrionarias", o SHEEFS (por sus siglas en inglés), en un artículo que advertía de que se acercan "muchas nuevas variedades", incluidos minicerebros realistas.
Shao, que continúa su formación en el MIT, profundizó en las cuestiones éticas y llegó a sus propias conclusiones. El investigador explica: "En seguida empezamos a prestar atención a por qué estábamos haciendo esto. ¿Es realmente necesario? Decidimos que sí, estamos tratando de hacer crecer una estructura similar a una parte del embrión humano temprano que de otra forma sería difícil de estudiar. Pero no vamos a generar un embrión humano completo. No puedo tener en cuenta tan solo mis sentimientos. Tengo que pensar en la sociedad."
Pero otros científicos están decididos a empujar los límites de la ciencia, e incluso valoran crear el primer embrión humano completo a partir de células madre. Ese es el caso del embriólogo Ali Brivanlou, que dirige un laboratorio en la Universidad Rockefeller, en la ciudad de Nueva York (EEUU). En un correo electrónico, el científico afirma: "Mi objetivo es maximizar el modelado, in vitro, del desarrollo humano. Por lo tanto, nos gustaría que fuera lo más preciso y completo posible".
Tomando forma
Los primeros científicos que consiguieron aislar células madre embrionarias a partir de embriones de pocos días que habían sobrado de una fecundación in vitro lo hicieron en Míchigan en 1998. Cuando un embrión está en sus primeros días no es mucho más que una masa de esas células idénticas e indiferenciadas. Su especialidad: formar cualquier otro tipo de célula en el cuerpo. Con la vista puesta hacia eventuales tratamientos médicos, las empresas las han utilizado para producir neuronas y células beta que responden a la insulina. Si se dejan solas en una placa, espontáneamente se convierten en músculo cardíaco y empiezan a latir.
Los científicos han comenzado a buscar formas de forzar a las células madre para que formen tejidos más complicados y organizados, llamados organoides. Estos órganos en miniatura no son auténticos. Son mucho más pequeños, del tamaño de granos de arena, y a menudo menos sofisticados. Pero presentan las características básicas de, digamos, las vías aéreas ramificadas y los cilios ondulados de un pulmón. El año pasado, los investigadores usaron organoides cerebrales para mostrar cómo el virus Zika puede infectar las células cerebrales.
En 2014, tales esfuerzos comenzaron a arrojar indicios de que, si recibían las señales correctas, las células eran capaces de recapitular los primeros eventos de un embrión. Al laboratorio de Brivanlou se le ocurrió acorralar las células madre dentro de pequeños puntos en una superficie con un micropatrón. Esto ayudó a producir un efecto sorprendente. Las células desarrollaron una "línea primitiva" organizada, una estructura de un embrión humano de dos semanas de vida en la que las células muestran las primeras señales de un diseño corporal, determinando qué lado será el izquierdo y cuál el derecho.
Esos embrioides no eran naturales. Eran delgados, crecidos como una hoja plana, y sus líneas eran circulares, no rectas como en un verdadero embrión. "Pero funcionó mejor de lo que creíamos", dice el profesor de la Universidad de Rice (EEUU) Aryeh Warmflash, quien dirigió el experimento cuando trabajaba en la Rockefeller. El experto explica: "Cada vez tenemos más pruebas de que las células están programadas para formar un embrión. Eso es lo que quieren hacer. Si las células están en la forma correcta, en la densidad correcta, y les das la señal correcta, las células simplemente toman el control a partir de ahí, se hablan entre sí".
En Míchigan, Fu dice que su laboratorio en colaboración con la bióloga Deborah Gumicio, creó su propio método para producir embrioides casi por accidente mientras estudiaba si las señales mecánicas, como hacer crecer las células en un gel blando o pegajoso, podrían mejorar su capacidad para formar ciertos tejidos.
Un experimento implicó alentar a las células intestinales a formar un lumen o quiste hueco. Como experimento de control, también cultivaron células madre embrionarias de la misma manera. Ahí fue cuando "actuó la serendipia", recuerda Fu. Las células madre se polarizaron en esferas que recordaban al comienzo de una cavidad amniótica. El investigador añade: "[Después] vimos todas las fascinantes características de autorganización".
Preguntas éticas
Pruebas posteriores demostraron que los embrioides sólo representaban una parte del embrión. Aunque tenían el comienzo de un saco amniótico, carecían de todo un linaje celular, llamado trofoblasto, cuyo papel es hacer la placenta. Y dentro del grupo de células que constituye el embrión propiamente dicho, los investigadores sólo detectaron uno de los tres tipos clave necesarios para hacer un cuerpo completo.
Cuando el equipo publicó sus resultados a principios de agosto, pasaron casi inadvertidos. Quizás porque los científicos escogieron cuidadosamente sus palabras, esforzándose por evitar comparaciones con embriones. Shao incluso llegó a usar el término "quiste asimétrico" para describir las entidades que habían sorprendido tanto al equipo. El experto admite: "Tenemos que ser cuidadosos al usar el término embrión humano sintético, porque algunas personas no están contentas con eso".

Foto: Un "embrioide" creado a partir de células madre comparte características clave con un embrión humano real, como un saco amniótico, pero carece de otros elementos. Crédito: Cortesía de Yue Shato, MIT.
Actualmente, los científicos de Estados Unidos y Reino Unido que trabajan con embriones humanos naturales observan un límite en su trabajo llamado "regla de los 14 días". Ningún embrión humano es estudiado más de dos semanas, o más allá de cuando se forme la línea primitiva, lo que ocurra primero. Antes de ese momento nadie piensa que tengan ningún tipo de sensibilidad y son "incapaces de sentir dolor", de acuerdo con el Informe Warnock de 1984 que consagró la regla.
Durante décadas, esa regla ha marcado una conveniente y clara línea en la arena. Y los mismos límites se están aplicando a los embrioides, al menos por ahora. Siguiendo las directrices promulgadas el año pasado por la Sociedad Internacional de Células Madre de Kimmelman, el equipo de Fu destruye las células sólo cinco días después de haberlas hecho. Esto evita que las estructuras desarrollen lo que los expertos en bioética denominan como "rasgos preocupantes", como un sistema nervioso primitivo.
Pero los científicos están dispuestos a defender que sus estructuras no son embriones reales y que deberían ser capaces de estirar el límite. Algunos expertos están pidiendo acabar con la regla, aduciendo que está obsoleta. El científico de la Escuela de Medicina de Harvard (EEUU) John Aach piensa que se necesitarán varas de medir éticas completamente nuevas para ayudar a guiar los ensayos con organoides. Por ejemplo, ¿podría un minicerebro cultivado en el laboratorio sentir sufrimiento? ¿Y puede nuestra definición de qué es un embrión resistir las pruebas de que los laboratorios pueden crear nuevos tipos nunca antes vistos? "Todos los grandes avances científicos exponen de alguna manera la imprecisión de conceptos comunes y fuerzan a la gente a repensarlos", dice Aach.
Incluso antes de que su artículo saliera, Shao estuvo persiguiendo a expertos en ética, entre ellos el profesor de la Universidad Case Western (EEUU) Insoo Hyun. El experto creía que el joven investigador pisaba un terreno seguro porque su estructura no contenía todas las partes de un embrión. Huyn detalla: "Creo que deberían diseñar experimentos centrados en preguntas específicas, en lugar de modelar todo el conjunto. Mi propuesta es, simplemente, no lo hagas entero. Un equipo puede hacer el motor, otro las ruedas. Cuanto menos moralmente ambigua sea la cosa es se está haciendo, más probable es que pueda hacerse la investigación sin obstáculos".
Hay otra razón para ser prudente. En la actualidad, varios países prohiben la financiación pública de cualquier estudio con embriones independientemente de cómo esté diseñado.
Si bien los embrioides actuales no parecen estar cubiertos por la restricción legal, podrían estarlo si los científicos los hacen lo suficientemente realistas. En respuesta a preguntas enviadas, la oficina de política científica de los Institutos Nacionales de Salud de EEUU (NIH), agencia de financiación con un presupuesto de anual más de 30.000 millones de euros, dice que tiene un procedimiento interno para analizar las subvenciones y determinar si "la investigación propuesta crearía un organismo que cumpla con la definición legal de un embrión humano".
Los científicos de Míchigan, cuyo proyecto utilizó fondos de dos subsidios de los NIH, dicen que los funcionarios de la agencia no han planteado objeciones hasta el momento. Por ahora, los embrioides viven y mueren en cajas de plexiglas y metal y se alimentan con medio de cultivo. "Debido a la gran manipulación que sufren estas entidades, podría argumentarse que no son organismos", dice Hyun. Ese es un punto que Shao también ha tratado de enfatizar. Cuando Shao presentó el trabajo del grupo este año, agregó a sus diapositivas una declaración ética destacada en una caja amarilla brillante, diciendo que los embrioides "no tienen la forma o el potencial de un organismo humano".
Pero tales definiciones podrían ser algo escurridizas. La esencia de estas estructuras es la manera sorprendente, autodirigida, incluso organísmica en que se desarrollan. El jefe del Proyecto Embrión Virtual, Robert Cork, mantiene las imágenes que el equipo de Míchigan utilizó para identificar sus estructuras. Cuando le pregunté por el artículo de Shao, me dijo que los embrioides podrían llegar a hacer algunas de las partes que actualmente no están presentes, si se permitiera progresar los experimentos. "Esto podría sugerir que si pueden mantener los quistes viables por más tiempo, podrían seguir adelante y empezar a convertirse en algo más 'parecido a un embrión'", dice Cork.
Alta producción

Foto: Jianping Fu es profesor de ingeniería mecánica en la Universidad de Míchigan.
Fu afirma que el siguiente paso de su laboratorio es perfeccionar los procedimientos para producir embrioides con características específicas y en mayor cantidad. Inicialmente, de cada 100 "quistes" que los científicos de Míchigan cultivaron, sólo cinco terminaron con la forma asimétrica que recuerda al saco amniótico. Pero ya han aprendido a hacer que esa forma aparezca. La producción de embrioides se convertirá en "programable y escalable", predice Fu.
Los fármacos se podrían testear en los embrioides, por ejemplo, para identificar los que tienen efectos tóxicos y causan alteraciones congénitas. La esperanza de Fu es que la embriología sintética pueda ayudar a los ingenieros a desarrollar órganos humanos completos. Fu detalla: "No estoy hablando de un cuerpo humano sin cerebro. Pero lo que es una posibilidad real es que podría desarrollarse un minintestino o un minihígado, ya que el embrión los desarrolla también. Y si tienes los órganos primitivos, podrían llegar a convertirse en unos funcionales". El laboratorio ha comenzado a cultivar embrioides en un chip del tamaño de una tarjeta de crédito. En él se esculpen seis microcanales, cada uno de ellos con capacidad para diez de las entidades, que se suspenden en hidrogeles y son alimentados con nutrientes mantenidos en cubos en miniatura. Fu lo llama "fabricación de alta producción".
De esta manera, dice, "todo puede ser activado y estar bajo control".


