
Formas fáciles y precisas de reescribir los genes humanos podrían ser las herramientas que necesitan los investigadores para comprender y curar algunas de las enfermedades genéticas más letales
A lo largo de la pasada década, según la tecnología de secuenciación del ADN se ha ido haciendo más rápida y barata, nuestro conocimiento del genoma humano ha crecido. Pero, hasta hace poco, los científicos eran bastante manazas a la hora de modificar directamente los genes de una célula viva. Tomemos la anemia falciforme como ejemplo. Es una enfermedad debilitante y con frecuencia mortal causada por una mutación en un único par de bases de ADN de los 3.000 millones con que cuenta un enfermo. A pesar de que este error genético es sencillo y está bien estudiado, los investigadores no pueden corregirlo para detener sus devastadores efectos.
Ahora existe la esperanza de poder hacerlo gracias a nuevas herramientas para la ingeniería genética, sobre todo una llamada CRISPR. Esta tecnología podría permitir a los investigadores hacer microcirugía de los genes para cambiar una secuencia de ADN con facilidad y precisión en puntos concretos de un cromosoma. Junto con una técnica llamada TALENs, inventada hace unos años, y una técnica predecesora ligeramente más antigua que se basa en unas moléculas llamadas nucleasas con dedos de zinc, CRISPR podría hacer que las terapias génicas se generalizasen, dando lugar a remedios para enfermedades genéticas sencillas como la anemia falciforme, y quizá a curas para enfermedades más complejas en las que se ven implicados múltiples genes.
La mayoría de las terapias génicas convencionales colocan el nuevo material genético a lo bruto en un punto al azar de la célula y sólo permiten añadir un gen. Por otra parte, CRISPR y las otras herramientas dan a los científicos una forma precisa de borrar y editar trozos específicos de ADN también, pudiendo cambiar un único par de bases, incluso. Esto significa que podrían reescribir el genoma humano a voluntad.
Lo más probable es que aún pasen algunos años antes de que estos esfuerzos se desarrollen en forma de terapias para humanos, pero una cantidad cada vez mayor de investigadores académicos ha tenido éxitos preliminares en experimentos con la anemia falciforme, el VIH y la fibrosis quística (ver Tabla 1). Uno de ellos es el investigador en bioingeniería del Instituto Tecnológico de Georgia (EEUU), Gang Bao, quien ya ha utilizado CRISPR para corregir la mutación de la anemia falciforme en células humanas cultivadas en placas. Bao y su equipo empezaron el trabajo en 2008 usando nucleasas de dedos de zinc. Cuando salió TALENs, su grupo cambió rápidamente, explica Bao, y también empezó a usar CRISPR en cuanto esta herramienta estuvo disponible. Aunque tiene intención de acabar trabajando sobre toda una serie de enfermedades, Bao sostiene que tiene sentido empezad por la anemia falciforme. "A la hora de escoger una enfermedad a tratar usando la edición genómica, debemos empezar por algo relativamente sencillo" afirma. "Una enfermedad causada por una única mutación en un único gen que implica un único tipo de célula".
Bao tiene una idea de cómo podría funcionar el tratamiento. Ahora mismo los médicos son capaces de curar a un pequeño porcentaje de los pacientes de anemia falciforme encontrando un donante humano cuya médula espinal case en términos inmunológicos con la del paciente; a continuación los cirujanos sustituyen algunas de las células madre de la médula del paciente por células del donante. Pero estos donantes tienen que ser muy afines al paciente, e incluso entonces el rechazo inmune (un problema potencialmente letal) es un riesgo grave. La cura de Bao evitaría todo esto. Tras cosechar precursores de las células sanguíneas denominados células madre hematopoyéticas de la médula de un enfermo de anemia falciforme, los científicos usarían CRISPR para corregir el gen defectuoso. Las células madre corregidas así se devolverían al paciente, produciendo glóbulos rojos sanos que sustituirían a las células falciformes. "Aunque sólo fuéramos capaces de sustituir el 50%, el paciente se sentiría mucho mejor", sostiene Bao. "Si sustituimos el 70%, el paciente estará curado".
Aunque la edición genómica usando CRISPR cuenta con poco más de un año, ya está reinventando la investigación genética. En concreto, ofrece a los investigadores la capacidad de hacer múltiples cambios genéticos simultáneos en una célula de forma rápida. Muchas enfermedades humanas, entre ellas las coronarias, la diabetes y varias condiciones neurológicas se ven afectadas por numerosas variantes tanto de genes relacionados con la enfermedad como de genes normales. Ensayar con esta complejidad en modelos con animales ha sido un proceso lento y tedioso. "Para responder a muchas de las preguntas de la biología, necesitamos saber cómo interactúan distintos genes, y para eso tenemos que introducir mutaciones en múltiples genes", explica el biólogo del Instituto Whitehead en Massachusetts (EEUU), Rudolf Jaenisch. Pero, según explica Jaenisch, usar herramientas convencionales para crear un ratón con una única mutación puede llevar hasta un año. Si un científico quiere un animal con múltiples mutaciones, los cambios genéticos se deben hacer de forma secuencial, y la cronología de un único experimento se puede extender a lo largo de varios años. En cambio, Jaenisch y sus compañeros, entre ellos el investigador del Instituto Tecnológico de Massachusetts (MIT) Feng Zhang (miembro en 2013 de nuestra lista de 35 innovadores menores de 35 años), informaron la primavera pasada de que CRISPR les había permitido crear una cepa de ratones con múltiples mutaciones en apenas tres semanas.
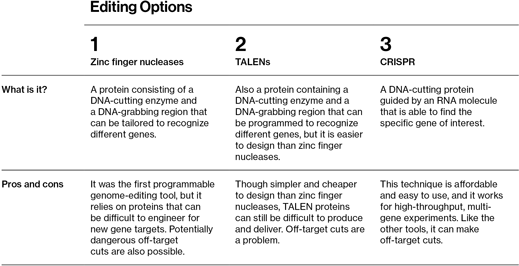
Tabla 1: Esta tabla resume y compara los tres tipos distintos de edición genómica
Como el sistema CRISPR se puede diseñar fácilmente para modificar cualquier gen concreto, la tecnología está permitiendo a los investigadores hacer experimentos que tocan un gran número de genes. En diciembre del año pasado, equipos dirigidos por Zhang y el investigador del MIT Eric Lander crearon bibliotecas de CRISPRs, cada una de las cuales tiene como objetivo un gen humano distinto. Estas vastas colecciones, que representan casi todos los genes humanos se han puesto a disposición de otros investigadores. Las bibliotecas prometen acelerar los estudios de todo el genoma en la genética del cáncer y muchas otras enfermedades humanas.
GPS del Genoma
La industria de la biotecnología nació en 1973, cuando Herbert Boyer y Stanley Cohen insertaron ADN ajeno manipulado por ellos en el laboratorio en bacterias. Pocos años después Boyer había cofundado Genetech, y la empresa empezó a usar E. coli modificado con un gen humano para fabricar insulina para diabéticos. En 1974, Jaenisch, que entonces estaba en el Instituto de Estudios Biológicos Salk en San Diego (EEUU), creó el primer ratón transgénico usando un virus para añadir al genoma del animal un poco de ADN de otra especie. Sin embargo, en estos y otros primeros ejemplos de ingeniería genética, los investigadores se veían limitados a usar técnicas que insertaban ADN ajeno en la célula al azar. Todo lo que podían hacer era esperar a que sucediera lo mejor.
Tuvieron que pasar más de dos décadas antes de que los biólogos moleculares tuvieran la pericia suficiente para cambiar genes específicos en los genomas de animales. Una investigadora de la Universidad de Utah, (EEUU) Dana Carroll, se dio cuenta de que las nucleasas de dedos de zinc, proteínas modificadas descubiertas por compañeros de la Universidad Johns Hopkins (EEUU) se podían usar como herramienta programable para la modificación de genes. Un extremo de la proteína se puede diseñar para reconocer una secuencia de ADN concreta; el otro extremo corta el ADN. Cuando una célula repara naturalmente esos cortes, poner un remiendo a su genoma al copiar el ADN ajeno que se le ha suministrado. A pesar de que la tecnología finalmente permite a los científicos la confianza de hacer cambios en el punto que quieren de un cromosoma, es difícil de usar. Cada modificación requiere que el investigador cree una nueva proteína hecha a la mediada de la secuencia que se quiere modificar, una tarea difícil y costosa en términos de tiempo que, debido a las veleidades de las proteínas, no siempre funciona.
TALENs, otro avance significativo en la edición genética, apareció en 2010. TALENs también son proteínas que encuentran y cortan una secuencia de ADN deseada, pero hacerlas a la medida de los objetivos genéticos es mucho más sencillo. Sin embargo, aunque representa una mejora importante respecto a los dedos de zinc, las TALENs son proteínas grandes con las que es complicado trabajar y que resultan difíciles de administrar a las células.
CRISPR lo ha cambiado todo. Sustituye las proteínas por un trozo corto de ARN que se engancha en los genes deseados. Al contrario que las complejas proteínas, el ARN, que tiene prácticamente la misma estructura sencilla del ADN, se puede fabricar rutinariamente en el laboratorio. Un técnico puede sintetizar rápidamente la secuencia de unas 20 letras necesaria para aplicar el método. El sistema hace que a los investigadores médicos les resulte fácil modificar un genoma sustituyendo, borrando o añadiendo ADN.
CRISPR es el acrónimo en inglés de "repeticiones de palíndromos cortos agrupados a intervalos regulares", grupos de breves secuencias de ADN que se leen parecido de delante hacia atrás que se encuentran en muchos tipos de bacterias. Los científicos observaron por primera vez estos enigmáticos segmentos de ADN en la década de 1980, pero durante casi otras dos no alcanzaron a comprender que forman parte del sistema de defensa bacteriano. Cuando las ataca un virus, las bacterias pueden incorporar secuencias del ADN viral a su propio material genético, metiéndolas entre los segmentos repetitivos. La siguiente vez que la bacteria se encuentra con ese virus, usa el ADN de estos grupos para fabricar ARN que reconoce la secuencia viral correspondiente. Una proteína ligada a uno de estos ARNs corta el ADN viral.
En 2012, la microbióloga médica que estudia patógenos en el Centro Helmholtz de Investigación en Enfermedades Infecciosas, Emmanuelle Charpentier, y una colaboradora de la Universidad de California en Berkeley (EEUU) Jennifer Doudna, demostraron que podían usar un único ARN en conjunción con la proteína cortadora, una enzima llamada Cas9, para cortar cualquier secuencia que quisieran de ADN en probetas. Aún no estaba claro si el método podría funcionar en células de animales, pero en enero de 2013 se produjo un avance radical. Zhang y el genetista de la Facultad de Medicina de la Universidad de Harvard (EEUU), George Church, informaron por separado de que el sistema CRISPR/Cas9 se podía usar para editar genes en las células de animales, y también en las de los humanos.
Ahora, un investigador que quiera lograr un nuevo gen sólo tiene que sintetizar la proteína Cas9 y un poco de ARN que encaje con la secuencia de la región objetivo. A continuación el ARN guía a la enzima hasta el ADN que el investigador quiere cortar. Y como se usa la misma proteína cortadora independientemente del gen objetivo, los investigadores pueden diseñar experimentos en los que cambian múltiples genes en un organismo simultáneamente usando Cas9 y múltiples guías de ARN. "Ofrece el potencial de hacer experimentos que en el pasado resultaban muy difíciles o esencialmente imposibles", explica Doudna.
Misterios complejos
A Zhang, del MIT y miembro también del Instituto Broad y del Instituto McGovern del Cerebro, le interesa la genética que hay detrás de las enfermedades mentales. Para intentar comprender estas condiciones complejas, Zhang ha ayudado a desarrollar herramientas para modificar múltiples genes y neuronas, entre ellos TALENs y la optogenética, una técnica que implica controlar la actividad neuronal con luz láser. Cuando oyó hablar de CRISPR por primera vez en 2011, empezó a diseñarlo para su uso en células humanas. Ahora está usando CRISPR para ayudar a revelar los secretos genéticos que hay detrás de enfermedades tan devastadoras y poco comprendidas como la esquizofrenia y el autismo.
La herramienta permite a Zhang a empezar a probar sistemáticamente algunas de las variantes del ADN que se han ligado a estas enfermedades. Aunque se ha progresado mucho en la última década en la identificación de genes comunes a quienes sufren estas enfermedades, comprender la relación de estos genes con los síntomas es un desafío dantesco. "Lo que aprendemos de la secuenciación sólo es una observación", explica Zhang: para poder comprender si un gen sospechoso causa realmente la enfermedad, hay que introducir la mutación específica en células u organismos sanos y ver qué sale mal. Si la célula o el organismo mutante tienen características que imitan la enfermedad humana, es una prueba de que ese gen está implicado en la misma.
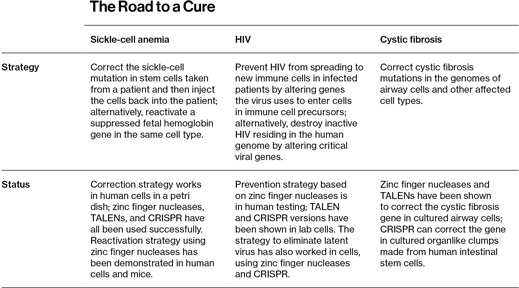
Tabla 2: Las estrategias de edición genética para curar la anemia falciforme, el VIH y la fibrosis quística y el estado en que se encuentran esas investigaciones.
Zhang es capaz de recrear, tanto en ratones de laboratorio como en células humanas cultivadas, variantes halladas en pacientes con autismo y esquizofrenia. "Puedes colocar una mutación humana en el gen correspondiente de un animal de laboratorio y observar: ¿ese animal es menos social o tiene un déficit de aprendizaje?", detalla. Después, añade, puedes estudiar diferencias en el comportamiento y la fisiología de las neuronas cultivadas en laboratorio partiendo de células madre que se han modificado con la misma mutación. "En el caso de las mutaciones de un único gen, empezaremos a ver aspectos de la función biológica involucrados en el autismo", afirma.
Zhang también está usando CRISPR para hacer múltiples cambios genéticos de una. Esto es algo especialmente importante en el caso de enfermedades complejas como el autismo y la esquizofrenia que, en general, no se producen debido a un único cambio en el ADN, como en el caso de la anemia falciforme. Distintos pacientes se ven afectados por distintas colecciones de mutaciones. Resolver un puzle tan complejo exigirá estudios sistemáticos y a gran escala sobre el efecto de varios genes y cómo interactúan. CRISPR permite la realización de este tipo de estudios, según Zhang, y será importante para encontrar tratamientos para toda una serie de enfermedades complejas. "Comprenderemos mejor las rutas metabólicas y mecanismos de la enfermedad", afirma. "Este conocimiento servirá para el desarrollo de todo tipo de fármacos".
Bebés de diseño
A finales del año pasado Doudna, Zhang, Church y otros dos pioneros de la edición genómica fundaron una start-up que desarrollará tratamientos novedosos para enfermedades genéticas humanas. En noviembre, la empresa, Editas Medicine, anunció que había recaudado 43 millones de dólares (unos 32 millones de euros) en capital riesgo y afirmó tener planes para usar tecnologías de edición del genoma para una gran variedad de enfermedades.
El lanzamiento de Editas debería beneficiarse del resurgimiento del interés por la terapia génica gracias a años de mejoras en la tecnología, entre ellas mecanismos más seguros para administrar los tratamientos. "El panorama ha cambiado para la terapia génica", afirma Church. (Aún no hay terapias aprobadas para su uso en Estados Unidos, aunque hay varias ya en ensayos con humanos). Pero afirma que las terapias desarrolladas por Editas serán distintas de los métodos anteriores que usan un virus para insertar un gen en las células.
"Hacer un cambio o borrar genes está fuera del alcance de la mayoría de esos métodos virales sencillos", explica Church. Y borrar un rozo de ADN, en vez de añadir un gen, quizá sea la clave para tratar muchas enfermedades. Por ejemplo la enfermedad de Huntington. Esta enfermedad cerebral mortal aparece con la acumulación de una proteína tóxica en las neuronas. Añadiendo una copia sana del gen a la célula no se alteraría la actividad venenosa de la proteína: la versión disfuncional original debe reescribirse. Con las nuevas herramientas de edición del genoma, explica Church, reescribir el ADN defectuoso podría hacerse: "No te limitas a añadir algo que falta". Y, sigue, "cuando empiezas a ver que las versión más común de los genes no es necesariamente la versión ideal, te das cuenta de que es un campo mucho más grande de lo que parece". Quizá los científicos puedan reescribir los genes normales para que los humanos puedan luchar mejor contra las enfermedades infecciosas. Quizá sean capaces incluso de cambiar las rutas metabólicas moleculares implicadas en el envejecimiento.
Church también predice que si la edición genómica se usa para curar enfermedades infantiles, algunos científicos se verán tentados a usarla para modificar embriones durante la fertilización in vitro. Los investigadores ya han demostrado que la edición genómica es capaz de reescribir secuencias de ADN en embriones de rata y ratón y, a finales de enero, investigadores en China informaron de que habían creado monos transgénicos usando CRISPR. Con estas técnicas, el genoma de una persona se podría editar antes de nacer o, si se hicieran cambios a los óvulos o el esperma, producir las células del futuro padre incluso antes de la concepción.
Estas posibilidades harán surgir problemas morales. Pero si los investigadores son capaces de demostrar que pueden corregir enfermedades de forma segura mediante la edición del genoma, resulta inevitable pensar que habrá padres que quieran alterar los genomas de embriones sanos. "Si se puede prevenir el retraso mental mediante la terapia génica, suponiendo que esté permitido, se abre toda una gama de retos intelectuales a debatir", afirma Church.
Este tipo de debates irán surgiendo según se vaya generalizando el uso de CRISPR. Por el momento, sin embargo, la tecnología aún está evolucionando: mientras que investigadores como Bao, Church y Zhang esperan poder acabar curando algunas de nuestras enfermedades más incurables, gran parte de su tiempo sigue dedicándose a afinar la herramienta y explorar sus posibilidades. Pero incluso en estos primeros tiempos, CRISPR ya ha transformado cómo estos investigadores piensan en manipular el genoma. Ya no son unos manazas.


