Los medicamentos actuales pueden costar cientos de miles de euros por año de tratamiento. La historia dos de ellos sugiere que la forma de establecer dichos precios servirá para decidir el futuro del sistema sanitario
En enero de 2012, tras apenas tres meses de revisión, la Agencia Estadounidense el Medicamento (FDA por sus siglas en inglés) aprobó Kalydeco, el primer fármaco para tratar la causa subyacente de la fibrosis quística. Fue una de las autorizaciones más rápidas en la historia de la agencia. Vertex Pharmaceuticals, descubridor y desarrollador del medicamento, fijó el precio de Kalydeco en 294.000 dólares anuales (unos 213.000 euros), lo que lo convirtió en uno de los fármacos más caros del mundo. La compañía se comprometió a proporcionarlo de manera gratuita a cualquier paciente de Estados Unidos sin seguro o cuyo seguro no lo cubriera. Tanto médicos como pacientes recibieron el medicamento con entusiasmo porque ofrece beneficios médicos salvavidas y no existe ningún otro tratamiento. Aseguradoras y gobiernos se apresuraron a pagar el coste.
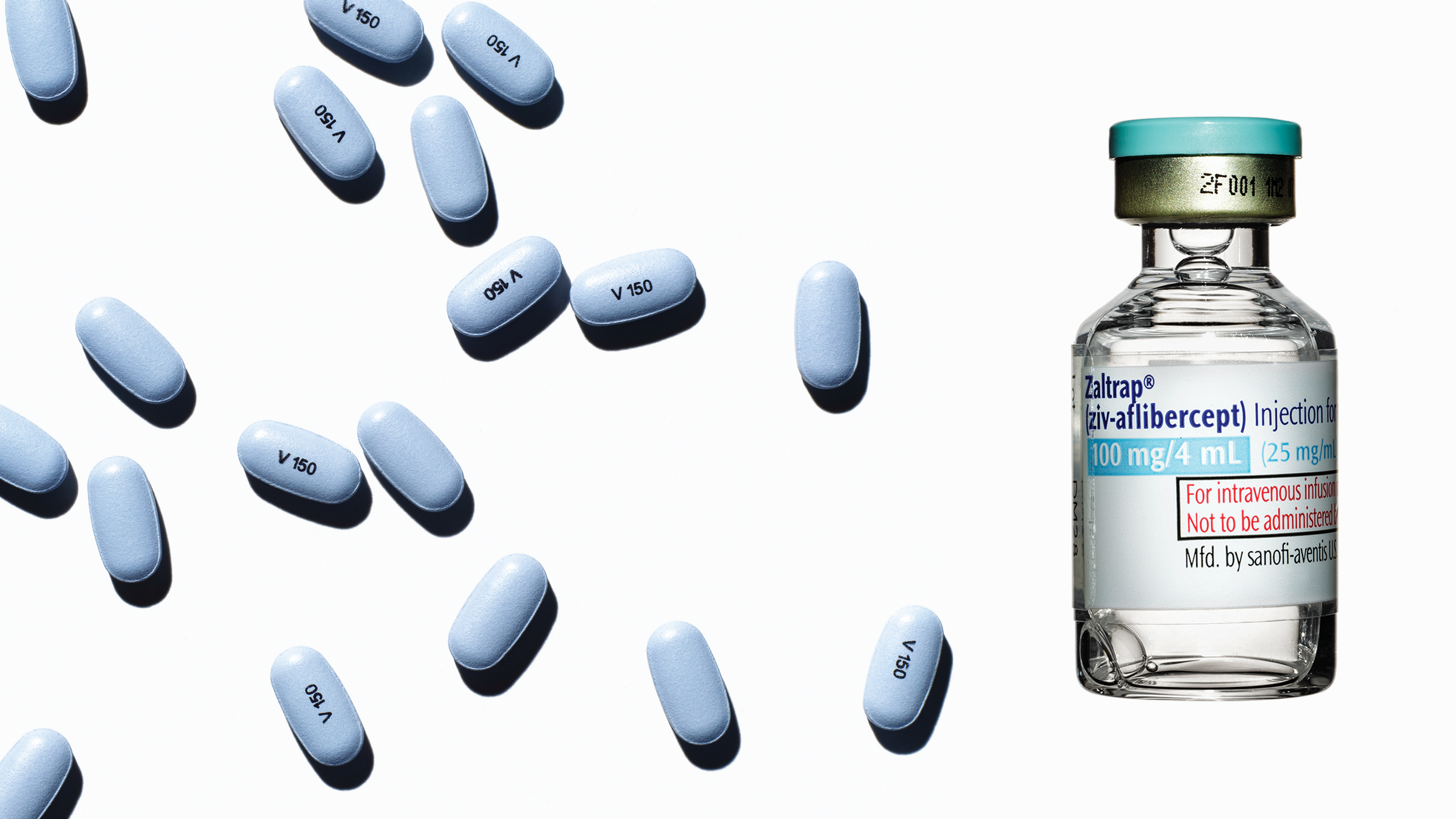
Varios meses después, la agencia aprobó Zaltrap para el tratamiento del cáncer colorrectal. El medicamento lo había descubierto Regeneron, una empresa biofarmacéutica emergente igual que Vertex, pero lo comercializó la farmacéutica francesa Sanofi. A pesar de que no había dados mejores resultados en los ensayos clínicos que Avastin, el medicamento contra el cáncer de Roche que a su vez sólo aumenta en 1,4 meses la esperanza de vida para pacientes con cáncer colorrectal avanzado, Sanofi fijó un precio para Zaltrap de 11.000 dólares mensuales (unos 7.900 euros), el doble de lo que cuesta Avastin.

Sorprendentemente, hubo quien se resistió. Los médicos del hospital Sloan Kettering en Nueva York (EEUU), uno de los principales centros para el tratamiento del cáncer en el mundo, decidieron que no merecía la pena recetar Zaltrap. Anunciaron su decisión -la primera vez que médicos destacados de cualquier parte del mundo decían "basta" a la introducción de un medicamento caro contra el cáncer- en la página editorial del periódico New York Times. Tres semanas después, Sanofi rebajó el precio a la mitad a través de descuentos a médicos y hospitales. Aún así, las autoridades sanitarias británicas declararon que no pagarían el tratamiento.
La FDA aprobó 39 nuevos medicamentos en 2012, la mayor cifra de aprobaciones en un año desde hacía una decada y media. Este hecho es una señal de que la industria farmacéutica puede estar recuperándose de su largo periodo de barbecho. Wall Street aplaudió el resurgimiento, sobre todo porque muchas empresas farmacéuticas se enfrentan a la caducidad de las patentes para sus productos de mayor éxito, y podrían encontrarse con menos ingresos tras años de escasa productividad investigadora. La mayoría de los medicamentos nuevos aprobados tratan enfermedades raras, como la fibrosis quística, o suponen mejoras marginales respecto a medicamentos contra el cáncer ya existentes. Todos son muy caros.
Pero si se observan detenidamente los lanzamientos de Kalydeco y Zaltrap, se aprecian diferencias sorprendentes en cómo las farmacéuticas valoran un medicamento y justifican su precio. También permite atisbar una idea del futuro probable en el que los fármacos carísimos son la norma.
Gracias a los seguros médicos, las reducciones por copago y los programas de acceso ampliado para quienes no tienen seguro, son relativamente pocos los estadounidenses que pagan más de unos miles de dólares anuales para los medicamentos de mayor precio. Los principales clientes en Estados Unidos no son los pacientes, ni siquiera los médicos particulares, aunque éstos pueden hacer aumentar la demanda de un fármaco. Los clientes son el Gobierno (a través del Medicare y Medicaid) y las aseguradoras privadas. Y como quien paga es la aseguradora o el Gobierno, las empresas se encuentran con que pueden establecer precios que muy pocos individuos podrían pagar, y lo hacen. En la jerga económica, la demanda de los medicamentos terapéuticos es "inelástica": el aumento de su precio no se reduce el consumo. Los precios se establecen y se suben dependiendo de lo que admita el mercado, y los actores encargados de pagar a las farmacéuticas pagarán el precio que sea por un medicamento eficaz para el que no existe alternativa. Así, al decidir el precio de un medicamento, las farmacéuticas se hacen preguntas que no tienen prácticamente nada que ver con su coste. "No es una ciencia", explica el veterano fabricante de medicamentos y antiguo director ejecutivo de Genzyme, Henri Termeer. "Es una sensación".
Existen problemas inherentes a un sistema en el que el Gobierno es uno de los grandes clientes y en el que médicos, hospitales, aseguradoras, farmacéuticos, empresas farmacéuticas e inversores esperan todos obtener grandes beneficios del tratamiento de personas enfermas, sin importar cuánto valor real añaden a las vidas de los pacientes o a la sociedad. Las farmacéuticas insisten en que tienen que ganar miles de millones de dólares por sus fármacos porque su índice de fracaso es muy alto, y porque tienen que convencer a los inversores de que es sensato meter dinero en investigación. Eso es cierto, pero también lo es que Estados Unidos, con menos del 5% de la población mundial, compra más del 50% de los medicamentos con receta. Y los compra a precios diseñados para subvencionar al resto del mundo industrializado, donde los mismos medicamentos cuestan mucho menos, a pesar de que la mayoría de los gobiernos pobres no pueden permitírselos siquiera a esos precios menores.
La pregunta obligada, por tanto, sería: ¿Cuándo resulta aceptable el precio elevado de un medicamento? Una cosa es que Vertex cobre 841 dólares (unos 610 euros) por dos pastillas cada día -durante toda la vida del paciente- por un medicamento que salvará esa vida, y otra muy distinta que Sanofi ofrezca un medicamento contra el cáncer que es el doble de caro que su alternativa, pero no ofrece ninguna ventaja evidente.
El susto del precio
La fibrosis quística es una dolencia cruel y agotadora que, además, resulta ser la enfermedad mortal hereditaria más común entre quienes tienen ascendientes de origen europeo. Afecta a unos 70.000 pacientes en todo el mundo, la mayoría localizados en América del Norte y Europa Occidental. La enfermedad deriva del mal funcionamiento de una proteína incrustada en las membranas de las células epiteliales que forman las densas capas que cubren las cavidades y superficies del cuerpo. La proteína CFTR es un canal de iones que permite entrar y salir de las células a los iones de cloro y al agua. Cuando su forma no es la correcta, los iones se bloquean, lo que provoca que los tejidos se congestionen con espesas secreciones mucosas. Esto, a su vez, bloquea el páncreas, el tracto gastrointestinal y los pulmones y vías respiratorias, a menudo, letalmente. El mecanismo que subyace en la fibrosis quística es, a la vez, tremendamente sencillo (una única proteína rota) y desgarradoramente diverso (existen 1.900 mutaciones conocidas del gen que causa la enfermedad).
Hace una generación, los enfermos de fibrosis quística no solían sobrevivir a la adolescencia y había pocas formas eficaces de aliviar los devastadores síntomas (incluso hoy, muchos pacientes tienen que recibir "golpes" rutinarios en el pecho para aflojar la mucosa). Pero la Fundación para la Fibrosis Quística (CFF por sus siglas en inglés), una enérgica pionera entre las organizaciones sin ánimo de lucro dedicadas a buscar activamente curas para distintas enfermedades, ha hecho mucho por cambiar lo que significa vivir con esta enfermedad. Al recaudar e invertir más de 600 millones de dólares (unos 435 millones de euros) para apoyar el desarrollo de terapias que conserven a los pacientes con vida, la fundación ha ayudado a desarrollar tratamientos que han multiplicado casi por tres la esperanza de vida mediante el alivio de los síntomas. Tras años de búsqueda de un socio dispuesto a investigar en medicamentos que ataquen el problema genético que origina la enfermedad, en el año 2000 la CFF invirtió en Aurora Biosciences de San Diego, adquirida por Vertex al año siguiente. La CFF acabó dedicando más de 100 millones de dólares (unos 73 millones de euros) a los proyectos de descubrimiento y primeros desarrollos de la empresa.
Kalydeco es una de los dos tipos de moléculas que Vertex está desarrollando para la fibrosis quística, y la decisión de empezar a usarla en primer lugar hizo surgir preguntas difíciles dentro y fuera de la empresa. La gran mayoría de los enfermos tienen lo que se denomina mutaciones de plegamiento; su proteína CTFR, mal formada, nunca llega a la superficie celular. Sin embargo, Kalydeco sólo arregla una mutación, denominada de apertura, en la que hay proteína suficiente en la membrana, pero los canales no se mantienen abiertos el tiempo suficiente como para permitir el paso de los iones. El medicamento está diseñado para tratar solo al 4% de los pacientes de fibrosis quística, unas 3.000 personas en todo el mundo; y en la actualidad sólo está aprobado para adultos y niños mayores de seis años, lo que reduce el total de pacientes potenciales a 2.400 personas. Promover un fármaco que no ayuda a la mayoría de los pacientes de fibrosis quística colocó tanto a Vertex como a la CFF (que recibiría ingresos significativos por derechos sobre la patente) en la incómoda posición de tratar a una parte diminuta de la población, mientras que la gran mayoría de enfermos espera a que la empresa cree un fármaco capaz de corregir las mutaciones de plegamiento. Pero, dado el estado de las investigaciones, Kalydeco parecía ofrecer la ruta más rápida para salvar, al menos, a algunos pacientes.
Vertex sabía que podía fijar un precio muy alto para Kalydeco porque los ensayos clínicos habían demostrado resultados impresionantes. Los pacientes que recibieron el fármaco informaron de una mejora del 17% en la respiración, en casos en los que incluso un 5% de mejora suponen una mejora sustancial en la calidad y cantidad de vida. Ningún otro medicamento se había llegado a proporcionar beneficios así. El fármaco hacía que los pacientes se sintieran muchísimo mejor y albergaran nuevas esperanzas para el futuro, puesto que el empeoramiento de la respiración y un mayor número de infecciones son las señales más seguras de que un paciente de fibrosis quística llega al final.
La empresa también sabía que debía convencer a aseguradores y médicos de que merecía la pena pagar ese precio por el fármaco. El farmacoeconomista jefe de Vertex Kyle Hvidsten, explica: "Hablamos del valor de Kalydeco de cuatro formas: gravedad de la enfermedad, eficacia, seguridad y magnitud estimada del beneficio". Vertex analizó estudios actuariales y modelos de cuánto podría valer Kalydeco, dado que los enfermos de fibrosis quística toman hasta 12 medicamentos diarios, necesitan frecuentes ingresos, tienen un deterioro sustancial según envejecen y, a veces la única salvación es un trasplante doble de pulmón. La proyección de la empresa afirmaba que al mejorar significativamente los indicadores relacionados con la respiración de un paciente y otros factores de riesgo como la absorción de calorías, Kalydeco "podía doblar la vida residual en el caso de algunos pacientes de fibrosis quística". Vertex incluyó los datos en un informe de más de 200 páginas que usó para responder a las preguntas de neumólogos y otros expertos que asesoran a las aseguradoras sobre cuánto deben pagar.
En el momento de su lanzamiento, Kalydeco costaba más que casi todos los fármacos del mercado salvo unos pocos, cerca de 3000.000 dólares anuales (unos 220.000 euros). Pero como era muy eficaz y no tenía competencia, y el impacto presupuestario era bajo dadas las alternativas, los aseguradores privados y públicos de Estados Unidos lo pagaron, mientras que los encargados de pagarlo en el resto del mundo se pusieron a analizar cuidadosamente sus beneficios. A pesar de todo, el precio asustó a muchas personas. La ecuación para establecer el valor aplicada por Vertex -que, a pesar de todo, no tuvo en cuenta el panorama social de quién paga y quién se beneficia- no convencía a algunos expertos. El codirector del Centro Palumbo para la Fibrosis Quística y presidente del comité ético del Hospital Infantil de Pittsburgh (EEUU) David Orenstein, se alegró de la aprobación de Kalydeco, pero le parecía que el precio representaba una escalada importante en el problema del aumento constante del coste de los medicamentos.
Orenstein recuerda: "Creo que todo el mundo reaccionó pensando: Eso no está bien". No creía que ni él ni nadie pudieran hacer nada para cambiar el precio, pero sí que él y sus colegas de profesión no podían "quedarse impasibles". Su centro había participado en los ensayos clínicos en humanos para el medicamento. Teniendo en cuenta el coste de otros tratamientos para la fibrosis quística, él y sus compañeros habían calculado que el precio podía superar los 100.000 dólares (unos 73.000 euros). Fue el shock del precio fijado finalmente por Vertex lo que los llevó a la acción. Él y cuatro médicos más escribieron una carta sobre su preocupación, y reclutaron a mas de 20 cofirmantes en todo el país. En julio, Orenstein envió la carta al director ejecutivo de Vertex, Jeffrey Leiden. Tras alabar Kalydeco y reconocer los esfuerzos de la empresa en la lucha contra la fibrosis quística, sus autores daban paso a varias objeciones:
"También le escribimos con un sentimiento de pesar y decepción porque el triunfo y el honor que merece su empresa se ven afectados negativamente por el precio desmedido adjudicado a Kalydeco. Somos conscientes de las complejidades financieras del tremendo gasto que supone la I+D en relación con el reducido número de pacientes, o el sistema de mercado que permite que estos avances se hagan realidad. Sin embargo -y sin menoscabar todos sus programas de apoyo a pacientes- como poco, resulta inadecuado que Vertex cobre a los planes de seguros de nuestros pacientes (incluyendo los empobrecidos programas sanitarios públicos) 294.000 dólares anuales por dos pastillas diarias (multiplicando por diez los costes de todos los medicamentos de un paciente medio). Con esta acción podría parecer que se están aprovechando del dolor y el sufrimiento para convertirlo en una inmensa ganancia financiera para los especuladores [...]. Escribimos con la sincera esperanza de que encontrará una forma de reflejar la humildad, generosidad de espíritu y consideración de las personas -no millonarios- que se beneficiarán de estos medicamentos. Si no, tememos que tanto ellos como nuestro sistema sanitario se enfrentan a la ruina provocada por costes fijados "según lo que admita el mercado"".
Leiden estaba más que dispuesto a defender a su empresa y su medicamento. Mandó una respuesta a Orenstein diciendo que estaría encantado de volar hasta Pittsburgh para hablar. Orenstein, sin saber qué pensar de la oferta de Leiden, lo debatió con sus compañeros y decidieron conjuntamente que no querían que él se presentase "como el abanderado moral en este tema". Propusieron, en cambio, que un grupo algo más grande se sentara a hablar con Leiden y otros miembros de Vertex en la Conferencia Anual sobre Fibrosis Quística de Norteamérica que se celebraría en Florida en octubre de 2012.
¿A qué precio?
Leiden no ha querido hacer declaraciones para este artículo, pero nadie discute lo que sucedió a continuación. "El que más habló fue Jeff", afirma Orenstein. "Fue encantador y parecía muy sincero. Quería que aquella fuera la primera de muchas reuniones. Nos sentíamos un poco incómodos representando a toda la comunidad relacionada con la fibrosis quística, pero dijo que quería nuestras aportaciones, que trabajásemos juntos. La razón por la que escribimos la carta fue el precio, pero cuando intentamos entrar en ese tema, resultó menos convincente".
El investigador de la Universidad de California en San Diego (EEUU) Paul Quinton, cuyos primeros trabajos contribuyeron al enfoque usado por Vertex y enfermo, él mismo, de fibrosis quística, recuerda a Leiden afirmando que la empresa dependía de los ingresos logrados gracias a Kalydeco para financiar su objetivo de curar la fibrosis quística para 2020. Nadie puso en duda el compromiso de Vertex: la empresa ya tenía un "corrector" para las mutaciones de plegamiento más comunes en ensayos clínicos de fase avanzada en humanos y crecía la excitación por las perspectivas de una terapia combinada con Kalydeco; uno o dos medicamentos para impulsar la proteína a la superficie de las células, otro para abrir el canal. Pero lo que preocupó a Quinton fue la lógica de Leiden. Afirma: "Salí de allí sintiéndome algo incómodo. El mensaje de Vertex era que necesitaban nuestro apoyo, y que si no lo tenían corrían el riesgo de que cayera el precio de sus acciones y los compraran. Si no estamos unidos en esto, perderemos 2020".
Leiden demostró que hablaba en serio de trabajar con Orenstein y su grupo. "Jeff nos escribió: ¿Qué hacemos ahora?", afirma Orenstein. "Tuvimos otra conversación con él. Dijo: ¿Por qué no venís a nuestra sede en San Diego para tener una reunión? Unas veinte personas. No era algo que quisiéramos, que nos sacaran a cenar y de copas. Yo tenía claro que quedaríamos impresionados por lo que están haciendo, pero gastar tanto dinero en llevarnos allí para que nos pusiéramos de su parte era un poco inquietante. Lo que están haciendo, tanto a nivel médico como a nivel individual, por los pacientes es fantástico, pero creemos que eso esquiva el tema del precio".
Fuera de Estados Unidos, lo que acepta el mercado lo deciden las autoridades sanitarias y ,en ese entorno, a Vertex le costó más asegurarse de que todos los pacientes tendrían acceso a Kalydeco. Según iba negociando con las autoridades extranjeras, fueron apareciendo noticias en prensa -primero en Inglaterra, Irlanda y Escocia, después en Australia, Nueva Zelanda y Canadá- centradas en pacientes, normalmente niños, que se podrían beneficiar del medicamento, pero que no lo iban a poder usar porque sus familias no se lo podían permitir. En julio, una portavoz de la empresa me confirmó que, negociando con el precio, la empresa se había movido rápidamente para dar acceso al fármaco a pacientes en el Reino Unido y en Irlanda . En Canadá, sin embargo, los pacientes aún están esperando.
Cuando Orenstein escribió a Leiden por primera vez, le preocupaba qué pasaría si Leiden le dijera: "Vale, me has convencido. ¿Cuál sería un mejor precio?". Orenstein admite que no lo sabe, y que la historia de Kalydeco -un triunfo médico y un éxito financiero, con ventas que superan las expectativas, y la CFF vendiendo una parte de sus derechos sobre las patentes por 150 millones de dólares según algunas fuentes (unos 108 millones de euros) y comprometiéndose a usar ese dinero para financiar más investigación- probablemente sea el sitio equivocado para empezar a crear argumentos contra la inmoralidad, despilfarro, avaricia y exceso de la industria farmacéutica. Orenstein explica que Kalydeco es distinto a otros medicamentos por dos motivos: "no existe un fármaco comparable, y representa un avance real, que ofrece mucho más valor que las cosas que ya existen. Si la única preocupación de la empresa es conseguir el precio máximo que admita el mercado, lo van a conseguir".
Efectivamente, este año Vertex subió el precio de Kalydeco a 307.000 dólares (unos 222.000 euros). El grupo formado por Orenstein y Leiden sigue buscando formas de trabajar juntos, aunque Quinton y otros no dejan de estar muy decepcionados. "No quiero presentarme como un hijo de puta santurrón, pero me inquieta muchísimo", me comentó Quinton. Orenstein, por otra parte, parece ser más comprensivo con las duras decisiones a las que se enfrentan empresas como Vertex. A la vista de los pacientes trasformados por Kalydeco, admite: "Este quizá sea el mejor resultado: lo que tenemos".
El precio importa
En mayo de 1998, el New York Times publicó un reportaje en primera página firmado por Gina Kolata en el que se elogiaban dos nuevos compuestos químicos "capaces de erradicar cualquier tipo de cáncer, sin efectos secundarios evidentes y sin resistencia al fármaco, en ratones". Kolata informaba sobre los hallazgos del médico del Hospital Infantil de Boston Judah Folkman, cuyos 30 años de trabajo habían llevado al descubrimiento de la angiostatina y la endostatina. Usados de forma combinada, los compuestos cortaban el suministro de sangre a los tumores, matándolos de hambre, y sin tocar los tejidos que los rodeaban. El descubridor de la doble hélice del ADN y ganador del premio Nobel, James Watson, le dijo a Kolata "En dos años Judah habrá curado el cáncer".
En toda la industria farmacéutica, las empresas corrieron para poner en marcha sus propios programas para atacar el mecanismo bautizado por Folkman como angiogénesis. El primer gran ganador de la lotería de la angiogénesis fue un anticuerpo creado mediante bioingeniería que bloquea la actividad de una molécula llamada VEGF que estimula el crecimiento de nuevos vasos sanguíneos. Avastin, de Roche, se aprobó en 2004 para el cáncer colorrectal avanzado y también se usa, a baja dosis, para tratar la degeneración macular, una causa común de la ceguera que se caracteriza por un crecimiento anormal de los vasos sanguíneos en la retina. Mientras, Regeneron, una empresa con una tecnología propia para "atrapar" objetivos moleculares, desarrolló ziv-aflibercept, también conocido como Trampa VEGF, que tenía unos resultados parecidos. En medio de la emoción por Avastin, Regeneron se asoció con la farmacéutica francesa Aventis, que después se fusionó con Sanofi. Esa empresa lanzó Zaltrap en agosto de 2012.
En los años transcurridos desde la publicación del artículo, el cáncer no se ha curado y ha surgido un nuevo orden económico en el que muchos médicos, hospitales y clínicas ganan más dinero cuanto más caro sea el precio de los medicamentos contra el cáncer. Este nuevo orden explica por qué Avastin, que finalmente parece improbable que mejore significativamente la salud de más de un puñado de pacientes, tuviera ventas por valor de 6.000 millones de dólares (unos 4.350 millones de euros) en 2012. Avastin y Zaltrap deben administrarse por vía intravenosa en un entorno médico. Los centros para el tratamiento del cáncer y los grupos de médicos adquieren el fármaco a un precio establecido por el fabricante y después buscan el reembolso de los pagadores a un precio mayor, una práctica conocida como "compra y factura". El margen, o "recuperación de costes", entre el precio de compra y el de reembolso aumenta los ingresos.
Así, no cuesta imaginar cuál es la postura de muchos hospitales y médicos respecto a los precios de los medicamentos. Evidentemente, lamentan el sufrimiento de sus pacientes y sus dificultades financieras, pero los precios más bajos son malos para el negocio. Las consultas pequeñas con cajas poco abultadas que no pueden mantener una oferta de medicamentos caros, se están quedando cada vez más fuera del juego, mientras que los grandes hospitales universitarios y las redes para el tratamiento del cáncer con ánimo de lucro, compiten por nuevos territorios, tecnologías y pacientes. El resultado es que estas instalaciones médicas avanzadas tienden a prosperar y pueden ofrecer algunos de los programas de tratamiento más sofisticados y eficaces disponibles en el mundo. Ofrecer los últimos avances en tratamiento es buena medicina, pero también es una exigencia del negocio.
En el hospital Memorial Sloan Kettering y otros grandes centros para el tratamiento del cáncer, la lista de medicamentos recetados la actualiza un grupo asesor formado por médicos y farmacéuticos. Al consejo del Sloan Kettering no le impresionaron los datos relativos a Zaltrap y, tras debatir sobre los costes, se puso en contacto con el director del Centro de Política y Resultados Sanitarios de la institución, Peter Bach. Bach había ejercido de asesor sénior del administrador de los Centros de Servicios de Medicare y Medicaid, que supervisa la sanidad para 100 millones de personas y suele escribir sobre cuestiones de reembolso para la revista Journal of the American Medical Association y otras publicaciones.
Bach relata: "Repasamos todos los datos sobre Zaltrap. Decidimos no administrar el medicamento exclusivamente sobre la base de que costaba más sin proporcionar beneficios adicionales. Éramos conscientes de que estábamos haciendo algo que nunca se había hecho, pero creíamos que había que demostrar algo". Poco después, Bach y sus coautores, entre ellos el jefe del servicio de oncología gastrointestinal del hospital, y el médico jefe del mismo, anunciaron la decisión del centro en la página editorial del New York Times bajo el titular "En el tratamiento del cáncer, el precio importa".
Prioridades perversas
Sanofi reaccionó enérgicamente, decidida a defender su decisión en la fijación de precios. Pero dado que Zaltrap no ofrece ninguna ventaja documentada sobre Avastin, tenía que basar su defensa en algo más que el valor para los pacientes.
La empresa desplegó a ejecutivos para que explicaran que el precio de Zaltrap era coherente con el de otros fármacos de "segunda línea" usados para tratar el cáncer colorrectal como último recurso, cuando ha fracasado el estándar de cura. En una entrevista con el autor la publicación sobre el negocio del cáncer, The Cancer Letter, Paul Goldberg, el vicepresidente y jefe de la unidad de negocios de oncología de Sanofi EEUU, Paul Hawthorne, y un colega, explicaron cómo se tomó esta decisión y el proceso que condujo a ella.
"Se tienen en cuenta muchas cosas", explicó Hawthorne a Goldberg. "Tienes en cuenta el estado del mercado; cómo se están usando las cosas; el número de agentes valiosos en segunda línea, entre ellos Erbitux y Vectibix; tienes en cuenta el valor que aportas al mercado; y buscas fijar un precio responsable, que es lo que hicimos al lanzar Zaltrap".
Sin embargo se equivocaron por mucho en sus cálculos. El 8 de noviembre, tres semanas después del editorial del Sloan Kettering, Sanofi anunció que rebajaría el precio real de Zaltrap a la mitad.
La empresa no cambió el precio oficial del medicamento, pero empezó a ofrecer rebajas y otros descuentos de alrededor del 50%. Ahí se resumían todas las prioridades perversas de "compra y factura". La acción de Sanofi era una recompensa a los médicos para que recetaran Zaltrap. En otras palabras, la decisión no se tomó para rebajar el coste para los pagadores, sino para mover a médicos e instituciones a aprovechar un margen económico excepcional y encargar el medicamento ya, mientras durase la oferta. "De repente, los médicos recibían un cheque del gobierno y de Sanofi", afirma Bach.
La estrategia de precios original de Sanofi y la rebaja favorable a los médicos que la siguió es una sorprendente demostración de cómo las disposiciones relativas a los costes pueden distorsionar los tratamientos al animar a los médicos y hospitales a recetar medicamentos que ofrecen beneficios clínicos limitados o inexistentes a sus pacientes. Pero la respuesta del Sloan Kettering también demuestra cómo un único consejo influyente con fuerte respaldo institucional puede lograr cambios significativos. Al igual que le sucedió a Vertex con Kalydeco, Sanofi se encontró con más problemas a la hora de lanzar Zaltrap en Europa. En junio, el organismo que controla los medicamentos en el Reino unido, el Instituto Nacional para los Cuidados de Salud y la Excelencia (NICE por sus siglas en inglés), rechazó reembolsar el coste del medicamento. En su análisis, NICE calculaba que el coste por "año ajustado a la calidad de vida", o QALY, una medida que se usa para evaluar el valor de una intervención médica en términos de su impacto tanto en la calidad como en la cantidad de vida por paciente para el Servicio Nacional de Salud británico (NHS por sus siglas en inglés) sería de 100.000 dólares (unos 73.000 euros), y el NHS ya ofrecía otros seis tratamientos para el cáncer coloerrectal avanzado. "Aunque el comité independiente ha considerado que Zaltrap es un tratamiento eficaz desde el punto de vista clínico", concluía el consejo asesor, "no se puede considerar un uso del NHS eficaz en términos de coste".
¿El punto de ruptura?
En última instancia, lo más importante al fijar el precio de un medicamento es su valor. Vertex acertó a la hora de poner precio a Kalydeco porque el fármaco funciona de verdad, porque los investigadores de la empresa conocían el perfil genético exacto de la gente que se beneficiaría, porque pudieron presentar resultados clínicos definitivos en ensayos bien planteados, y porque la empresa se aseguró de que los pacientes adecuados recibían el fármaco y de que no se producía un problema de acceso al mismo. Este medicamento supone una diferencia cuando, además, no existe ningún otro tratamiento que lo consiga. Sanofi ha fracasado -por el momento- con Zaltrap porque aún no se sabe qué puede hacer para los pacientes individuales, y la única forma de saber quién se puede beneficiar es a través del ineficaz y costoso método de ensayo y error. Y, además, porque en el mejor de los casos su valor es indeterminado y, en el peor, no mayor que una alternativa poco eficaz que cuesta la mitad.
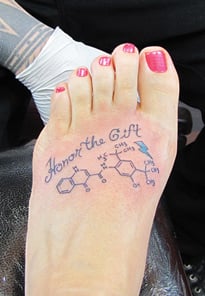 Cuando la salud de su hijo Brady mejoró, Rebecca Schroeder se tatuó la estructura molecular de Kalydeco en el pie.
Cuando la salud de su hijo Brady mejoró, Rebecca Schroeder se tatuó la estructura molecular de Kalydeco en el pie.
Si las investigaciones que están en marcha tienen éxito, cada vez será más frecuente que aparezcan medicamentos contra el cáncer muy eficaces para un grupo limitado y muy definido de pacientes, igual que Kalydeco lo es para un pequeño subgrupo de los enfermos de fibrosis quística. Esto son buenas noticias para esos pacientes, pero encarecerán aún más el coste de los medicamentos. El jefe de la división de hematología y medicina oncológica del Hospital Mount Sinai en Nueva York, William Oh, sugiere que estos últimos años en investigación contra el cáncer han supuesto un punto de inflexión. Espera que cuando los médicos tengan más información sobre la genética de sus pacientes y las mutaciones específicas que generan su enfermedad, y cuando la detección temprana se convierta en la norma, los tratamientos contra el cáncer sean cada vez más específicos, y cada vez más eficaces para los pacientes adecuados.
Oh sostiene: "Hemos empezado a esperar que los medicamentos se desarrollen específicamente para esta o aquella anomalía. Hace una década eso sería impensable, o tenías un fármaco que tratara todos los tipos de cáncer de pulmón, que es una población muy grande, o no lo tenías y veías si funcionaba o no. Pero ahora sabemos que si tienes una anomalía en tu cáncer tienes un índice de respuesta muy bueno a ese medicamento. El problema es que, en el caso del cáncer, estamos hablando de muchas enfermedades distintas, con decenas, puede que cientos de anomalías distintas que generan estos cánceres. Eso hace que la capacidad de desarrollar medicamentos para cada subgrupo sea muy difícil y, en algunos sentidos, aún más caro".
Averiguar qué pacientes se beneficiarán más de qué combinación de fármacos es lo único que, al final, podría hacer que se instaurase un método de fijación de precios basado en el valor en Estados Unidos. Hay algunos primeros casos de progresos hacia este objetivo. Por ejemplo, más del 60% de los medicamentos nuevos en estudio en Roche se están desarrollando junto con pruebas diagnósticas genéticas para identificar a los pacientes con mayor probabilidad de resultar beneficiados. Estas pruebas optimizarían los resultados y los costes, y logran una mayor racionalidad en el proceso de fijación de precios para nuevos tratamientos. Oh afirma: "Creo que todo el mundo se da cuenta de que es una tremenda prioridad: averiguar qué pacientes se beneficiarán de qué fármacos, dada la heterogeneidad tanto del coste de los tratamientos como de las propias enfermedades".
Aunque la llegada de estos fármacos más específicos y eficaces introducirá la posibilidad que los precios sean cada vez más altos, los denominados medicamentos huérfanos, como Kalydeco, que son muy eficaces y carísimos, quizá creen una categoría más estricta para fijar el precio de todos los medicamentos nuevos. Poder identificar con mayor precisión los efectos de nuevos tratamientos y los pacientes que se beneficiarán de ellos debería permitir que, al final, las empresas fijen el precio de estos fármacos basándose sólo en su valor real. Entonces, será la sociedad quien deba decidir si los precios resultantes "merecen la pena".
El libro de Barry Werth The Billion-Dollar Molecule (1994) describe los primeros pasos de la start-up Vertex. Una secuela que analiza Verrtex 20 años después se llama The Antidote y saldrá a la venta en febrero del año que viene.


