
Los científicos llevan décadas intentando desentrañar los intrincados misterios del apetito humano. ¿Están a punto de determinar finalmente cómo funciona este impulso básico?
No has visto el hambre hasta que no has visto los ratones de Brad Lowell.
Hace unos años, Lowell, neurocientífico de la Universidad de Harvard, y Mike Krashes, un investigador postdoctoral, descubrieron cómo subir al máximo el volumen del impulso por la comida. Lo hicieron estimulando un haz de neuronas del hipotálamo, una zona del cerebro que se cree que desempeña un papel clave en la regulación de nuestras necesidades básicas.
Un vídeo recoge lo que ocurrió a continuación. Al principio, la escena es tranquila y la cámara recorre lentamente una serie de jaulas de plástico, cada una de ellas ocupada por un ratón dócil y bien alimentado, tumbado sobre un lecho de virutas de madera. Ninguno de los ocho ratones mostrados se interesa por las bolitas de comida dispuestas sobre ellos al otro lado de una rejilla metálica triangular que cuelga del techo. Lo cual no es sorprendente, ya que cada ratón acaba de consumir el equivalente roedor de una cena de Acción de Gracias.
Sin embargo, a medida que transcurren los segundos indicados en un temporizador situado en la parte inferior de la pantalla, la mitad de los ratones comienzan a agitarse: la primera prueba de que un agente químico diseñado para activar neuronas específicas asociadas al apetito está llegando a sus objetivos.
Pronto, los ratones parecen poseídos. Algunos se ponen de pie sobre sus patas traseras, metiendo la nariz por las rejillas que tienen encima para alcanzar los inaccesibles gránulos. Otros trepan por las paredes, se cuelgan de los barrotes de la rejilla o escarban frenéticamente entre las virutas de madera.
"Parece que están perdiendo la cabeza", dice Lowell.
Lowell, que es uno de los mayores expertos mundiales en los circuitos cerebrales que controlan el hambre, la saciedad y la regulación del peso, a veces hace referencia a este vídeo para argumentar: cuando te mueres de hambre, el hambre es como un demonio. Se despierta en las partes más antiguas y primitivas del cerebro y se apodera de otra maquinaria neuronal para que cumpla sus órdenes hasta que consigue lo que quiere.
"Claro, logramos que el cerebro dijera 'Ve a comer'", dice Lowell. “Pero eso no es realmente una explicación. ¿Cómo funciona en realidad?"
Lo que puede empezar como una pequeña sensación se convierte rápidamente en una espiral. Pensamientos intrusivos sacados de nuestros centros de memoria irrumpen en nuestra conciencia. Imágenes de bocadillos de albóndigas. El olor a pan. El sabor imaginado de una bolita de comida parecida a un corcho. Las áreas motivacionales y emocionales de nuestro cerebro infunden a la necesidad de comer un imperativo no verbal tan poderoso que eclipsa todo lo demás. Nuestro córtex prefrontal se pone en marcha, considerando cómo podríamos obtener la comida (si estamos en una situación peligrosa, como una zona de guerra, sopesamos cuánto peligro estamos dispuestos a correr para conseguirla). Entonces movilizamos nuestras áreas sensoriales y motoras. Robamos una gallina, intentamos pescar un pez en un estanque, asaltamos el frigorífico del trabajo o lanzamos nuestro cuerpo contra una rejilla metálica con la esperanza de probar una bolita de comida.
Así, al excitar las neuronas del hambre en esos ratones, Lowell catalizó una tormenta de actividad neuronal que se extendió a la corteza cerebral y a otros centros de procesamiento de orden superior, conduciendo directamente a una cadena de comportamientos complejos dirigidos a objetivos (por muy ineficaces que resultaran).
A Lowell también le hizo comprender lo mucho que nos queda por aprender.
"Claro, logramos que el cerebro dijera 'Ve a comer'", dice. "Pero eso no es realmente una explicación. ¿Cómo funciona en realidad?".
Para responder a esa pregunta, Lowell se ha asociado con Mark Andermann, neurocientífico que estudia cómo la motivación determina la percepción (y que casualmente ocupa el despacho contiguo al suyo en el Centro Médico Beth Israel Deaconess de Boston). Juntos están siguiendo partes conocidas de los circuitos neuronales del hambre hasta zonas inexploradas del cerebro, en algunos casos activando una neurona cada vez para trazar metódicamente nuevas conexiones a través de zonas tan primitivas que las compartimos con los lagartos.
Su trabajo podría tener importantes implicaciones para la salud pública. Más de 1.900 millones de adultos en todo el mundo tienen sobrepeso y más de 650 millones son obesos, una condición relacionada con una amplia gama de enfermedades crónicas, como la diabetes, la enfermedad por hígado graso, las cardiopatías y algunos tipos de cáncer. Comprender los circuitos implicados podría arrojar nueva luz sobre los factores que han hecho que esas cifras se disparen en los últimos años.

Y también podría ayudar a resolver el misterio que se esconde tras una nueva clase de fármacos para adelgazar conocidos como agonistas del receptor del GLP-1. Muchos profesionales de la salud pública consideran que estos fármacos, entre los que se incluyen Wegovy y Ozempic, son transformadores, ya que proporcionan el primer método eficaz para combatir la obesidad y permiten a algunas personas perder más del 15% de su peso corporal. También se han convertido en una especie de fenómeno cultural: en los tres últimos meses de 2022, los profesionales sanitarios estadounidenses recetaron más de 9 millones de estos fármacos. Sin embargo, nadie puede explicar con precisión cómo y por qué funcionan. En parte se debe a que los científicos aún no han descifrado la compleja maquinaria neuronal que interviene en el control del apetito.
"Los fármacos están produciendo los efectos beneficiosos, los efectos saciantes, a través de algún aspecto de este sistema más amplio", afirma Lowell, que ha observado su aparición con sorpresa y auténtica fascinación. "Uno de los componentes más importantes para averiguar cómo funcionan es definir cuál es el sistema. Y eso es lo que estamos haciendo".
Pero el objetivo último de Lowell y Andermann es mucho más ambicioso que simplemente aplicar ingeniería inversa a cómo funciona el hambre. Los científicos buscan el escurridizo haz de neuronas que permite a nuestro impulso instintivo de comer controlar estructuras cerebrales de orden superior implicadas en la motivación, la toma de decisiones, la memoria, el pensamiento consciente y la acción humanas. Creen que identificar estas neuronas permitirá estudiar cómo un simple impulso básico —en este caso, una señal del cuerpo de que las reservas de energía empiezan a escasear y hay que reponerlas— se propaga por el cerebro para dominar nuestra experiencia consciente y convertirse en algo mucho más complejo: una serie de acciones complicadas, a menudo bien pensadas, diseñadas para conseguir comida.
Esta búsqueda ha consumido tanto a Lowell en los últimos años que sus estudiantes de posgrado han acuñado un término para el escurridizo conjunto de células cerebrales que busca: neuronas del "Santo Grial".
Puede sonar como un tropo científico trillado. Pero para el discreto Lowell, el término es perfectamente adecuado: lo que está buscando llega al corazón mismo de la voluntad humana. Encontrarlo sería la culminación de décadas de trabajo y algo que nunca imaginó que sería posible durante su vida.
El misterio del hambre
A Brad Lowell le gusta bromear diciendo que es el "residente local de turno" del Beth Israel Deaconess Medical Center. Nacido en el hospital contiguo al lugar donde ahora investiga, creció a 40 km al norte, en la ciudad de Boxford, y estudió en la Universidad de Massachusetts, en Amherst, a un par de horas en coche.
Poco después de llegar a la UMass como estudiante a finales de la década de 1970, fue aceptado en el laboratorio de psicología fisiológica de Richard Gold, un neurocientífico pionero que trabajaba en la identificación de estructuras neuronales implicadas en la regulación del apetito.
Gold se centró en el hipotálamo, una estructura primitiva de las profundidades del cerebro que no ha cambiado mucho a lo largo de la evolución. Se cree que es responsable de mantener el cuerpo en homeostasis, controlando y equilibrando funciones importantes como la temperatura corporal, la presión arterial, nuestra necesidad de alimentos y agua, y otros impulsos básicos.
Gold sospechaba que el núcleo paraventricular (NPV), una pequeña porción de unas 50.000 neuronas en el hipotálamo, desempeñaba un papel en el control del apetito. Según los estándares actuales, las herramientas para estudiarlo en aquella época eran "de la Edad de Piedra" —Lowell dice que utilizó un "cuchillo de alambre retráctil" para cortar haces de proyecciones neuronales que emanaban del NPV y se conectaban a neuronas fuera de él—, pero eran eficaces. Cuando los roedores anestesiados que Lowell había operado se despertaron, estaban enloquecidos de hambre y rápidamente se volvieron obesos.
La experiencia le causó una impresión duradera. Lowell, entonces un atlético aficionado al fútbol de 19 años, siempre había asumido que cualquiera que tuviera sobrepeso era simplemente "vago". El experimento sugirió que era mucho más que eso. También convenció a Lowell para que se convirtiera en científico.
Sin embargo, la investigación sobre el funcionamiento preciso del cerebro para controlar el hambre y la saciedad había llegado a un punto muerto.
"Gold y algunos otros laboratorios pusieron el NPV en el mapa como un lugar obligado para refrenar qué se come", explica Lowell. "Pero no tenían las herramientas para buscar más allá".
Averiguar cuáles de las 50.000 neuronas del NPV eran realmente importantes para el apetito, las que esencialmente podían silenciar el interruptor del hambre, era un reto que parecía insuperable, algo así como, en palabras de Lowell, intentar desenredar un "enorme plato de espaguetis".
"¿Cómo diferencias un espagueti de otro, entendiendo que estos son neuronas?", pregunta. "No hay manera. Todos parecen iguales".
Cuando Lowell abrió su propio laboratorio en el Beth Israel Deaconess Medical Center a principios de la década de 1990, tras obtener el título de médico y doctor por la Universidad de Boston, estudiaba el metabolismo de tejidos como los músculos, los órganos y la grasa, conectados al cerebro a través del sistema nervioso periférico. Pero su experiencia universitaria en el laboratorio de Gold le asediaba.
"El cerebro es el Señor de los Anillos", dice Lowell. "Es el Anillo Único que los gobierna a todos. Y no era tan interesante estudiar estas otras cosas cuando el jugador maestro estaba ahí arriba".
El punto de partida
Al principio de su carrera, Lowell envidiaba a sus colegas que estudiaban la visión. Durante décadas, los neurocientíficos habían podido rastrear los circuitos neuronales implicados en esa función iluminando los ojos de ratones, identificando qué neuronas se iluminaban y siguiéndolas para trazar los circuitos cerebrales pertinentes. Lowell y sus colegas, interesados en el hambre, nunca habían tenido un punto de partida similar.
Eso cambió en 1994, cuando Jeffrey Friedman, investigador de la Universidad Rockefeller, proporcionó a Lowell y a otros una forma de identificar las primeras neuronas importantes (o "espaguetis" individuales) implicadas en la regulación del hambre.
En 1949, unos científicos del Laboratorio Jackson de Bar Harbor (Maine) habían criado ratones con una mutación genética no identificada que les provocaba obesidad masiva. Su hipótesis era que la obesidad se debía a la incapacidad de los ratones para producir una proteína crucial para la regulación del peso.
Décadas más tarde, Friedman fue el primero en aplicar tecnologías genéticas de vanguardia para clonar las secuencias de ADN anormales en los ratones obesos y confirmar que su obesidad se debía a la incapacidad de producir una hormona clave liberada por las células adiposas, que el cerebro utiliza para controlar las reservas de energía disponibles. Friedman purificó la hormona y la bautizó como leptina. También identificó la secuencia de ADN necesaria para fabricar el "receptor" de leptina, las proteínas especializadas que sobresalen de las células cerebrales implicadas en la regulación del apetito como antenas microscópicas, que detectan la presencia de leptina y ponen en marcha una cascada química que promueve la sensación de saciedad.
El descubrimiento aportó más pruebas a la idea de que la obesidad estaba determinada biológicamente y, más concretamente, al concepto de set point o "punto establecido" en lo que se refiere al peso: un peso, masa grasa u otra característica fisiológica predeterminada y medible que el cuerpo defenderá. El apetito es el medio por el que el cuerpo "subsana errores" y se moviliza para dedicar energía y atención a la tarea de restablecer la homeostasis.
De repente, la "cura" de la obesidad parecía al alcance de la mano. La empresa de biotecnología Amgen obtuvo la licencia de los derechos de la leptina por 20 millones de dólares, con la esperanza de desarrollar un fármaco que pudiera imitar sus efectos. Sin embargo, el fármaco que se desarrolló tenía muy poco efecto en la mayoría de las personas obesas, lo que sugería que la leptina era sólo una parte de la historia, una hipótesis que pareció confirmarse cuando otros laboratorios descubrieron otras hormonas y señales que parecían estar implicadas en el hambre. Otros experimentos demostraron que muchos obesos tenían niveles normales o elevados de leptina.
Era lógico, pues, que en algún lugar del cerebro la leptina se combinara con otras señales relacionadas con la energía disponible, y que esta información tuviera que compararse después con un "punto establecido" homeostático.
Esto sugería la existencia de un conjunto muy complejo de circuitos neurológicos implicados en la regulación del hambre. Para comprender el funcionamiento de este proceso se necesitaría un esquema eléctrico detallado que explicara cómo encajan todas las piezas. Y aunque los descubrimientos de Friedman sobre la leptina no respondían a todas las preguntas, proporcionaban el punto de partida que Lowell y el resto de los investigadores estaban esperando, permitiéndoles empezar a dibujar ese mapa.
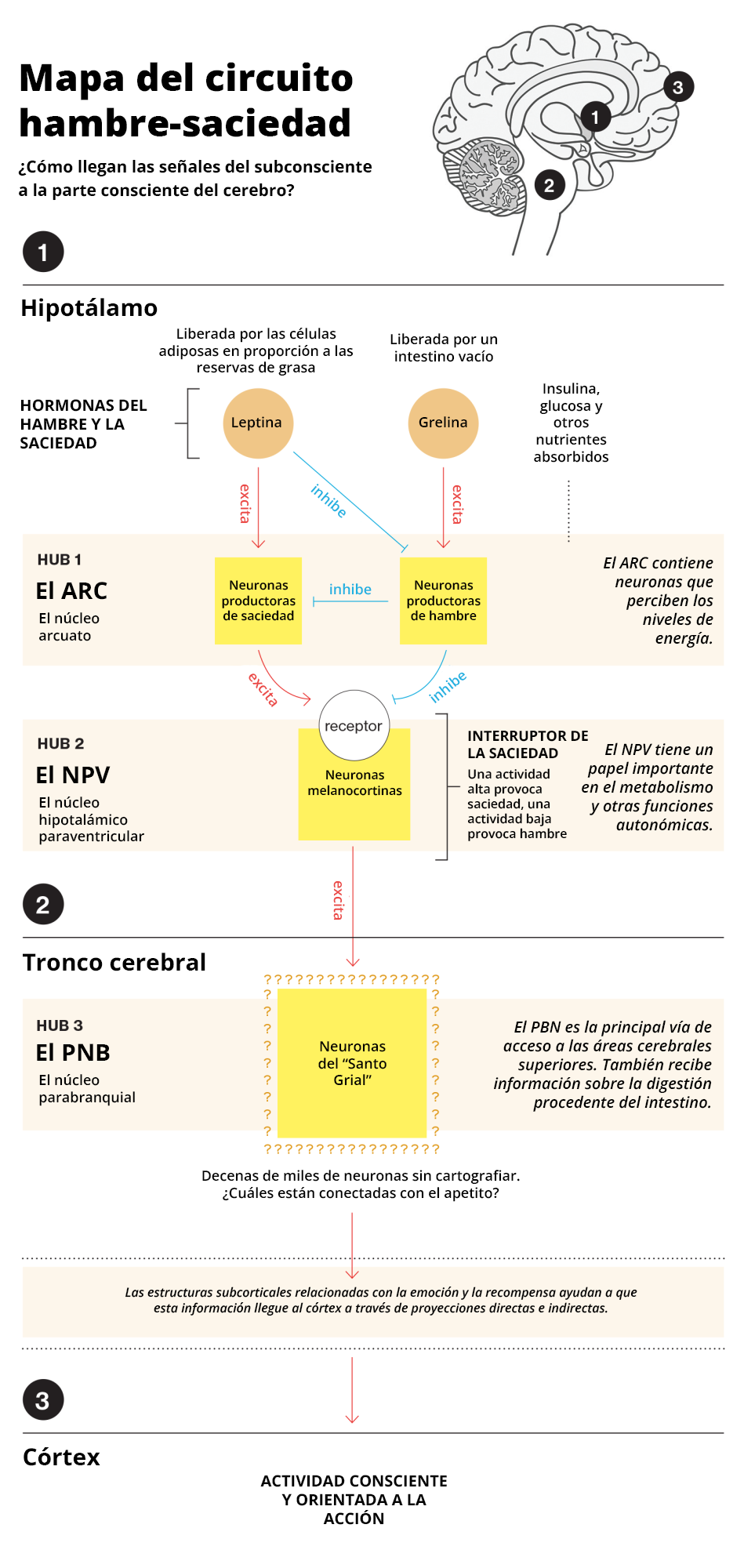
Siguiendo el camino de la leptina, científicos de otros laboratorios encontraron la primera diana de la hormona y, por tanto, la primera parada importante en el circuito del hambre: una zona específica de neuronas conocida como núcleo arqueado o arcuato (ARC). Situado en la base del hipotálamo, el ARC integra información procedente de otras estructuras cerebrales, así como de nutrientes y hormonas circulantes como la leptina y la insulina. Todas estas entradas transmiten información clave sobre el estado actual del organismo, como el nivel de reservas energéticas existentes y la disponibilidad de nutrientes.
Determinar cómo funcionaba el ARC y a dónde enviaba la información después de recibirla era la siguiente cuestión a la que se enfrentaba el campo. Para entonces, Lowell había abandonado los estudios sobre sistemas periféricos y se había sumado a la caza.
Encender y apagar el hambre
En 1997, la siguiente pieza del rompecabezas encajó después de que Roger Cone, entonces investigador de la Universidad de Salud y Ciencia de Oregón, descubriera una parte clave del interruptor que básicamente activaba y desactivaba el hambre.
Crio ratones con una mutación genética que interfiere con otro tipo de proteínas de señalización clave, las melanocortinas. Los ratones con esta mutación se parecían más a los humanos obesos que los ratones con mutaciones en la leptina: su obesidad aparecía relativamente tarde y tenían niveles de insulina y glucosa que provocaban diabetes. Esta mutación en concreto impedía que unos receptores clave detectaran las hormonas melanocortinas, lo que a su vez interfería en la sensación de saciedad y hacía que los ratones siguieran comiendo. Pero cuando estos receptores de melanocortina funcionaban con normalidad, la detección de la presencia de las melanocortinas parecía reducir el apetito. En esencia, Cone había encontrado los "interruptores de la saciedad" del cerebro.
Este descubrimiento fue fundamental para ayudar a los científicos a determinar cómo actuaba la leptina en el ARC, la primera parada del circuito del hambre. Resultó que cuando la leptina llegaba al ARC, producía una reacción bioquímica en cadena que hacía que se liberaran más hormonas melanocortinas, activando finalmente estos "interruptores de la saciedad".
Pero estos interruptores de la saciedad no estaban presentes únicamente en el ARC, sino también en neuronas distribuidas por el hipotálamo, el rombencéfalo y el prosencéfalo, lo que sugiere que una de estas zonas era el siguiente nodo clave del circuito del hambre. Entonces, ¿cuál de ellos era?
Sin embargo, seguía sin responder a la pregunta más fascinante de todas: ¿cómo llegaban estas señales a las partes conscientes del cerebro?
Algunos de estos interruptores se encontraban en el núcleo hipotalámico paraventricular, la zona del cerebro que Lowell había estudiado en el laboratorio de Richard Gold cuando era estudiante. Como Lowell había visto con sus propios ojos que los ratones comían vorazmente si se les desconectaba, hacía tiempo que creía que el NPV era una parada de ese circuito.
Ahora tenía las herramientas para demostrarlo. A lo largo de los años, Lowell se había especializado en las técnicas más avanzadas de ingeniería genética, lo que le permitió eliminar genes específicos y crear nuevas cepas de ratones knockout. Es decir, se habían eliminado genes específicos de un embrión, de modo que el ratón nacía sin una copia funcional.
En 2005, Lowell y un colega, Joel Elmquist, crearon ratones portadores de una secuencia genética que les impedía fabricar copias funcionales de los interruptores de la saciedad en cualquier parte del cerebro. Como era de esperar, los ratones se volvieron obesos.
Lowell y Elmquist crearon entonces pares de tijeras moleculares microscópicas. Utilizando genes exclusivos de las neuronas del NPV como faro, programaron estas tijeras para que buscaran únicamente el ADN asociado a las neuronas del NPV y cortaran la pequeña secuencia que impedía el desarrollo de interruptores de la saciedad funcionales en esa parte del cerebro. En otras palabras, "arreglaron" los interruptores de la saciedad en el NPV, mientras que permanecían desactivados en el resto del cerebro. Si el NPV era el lugar donde se producía la magia, restaurar allí los interruptores de la saciedad solucionaría el problema de la obesidad.
De hecho, los ratones knockout de Lowell se "curaron" de la obesidad, lo que confirmó su hipótesis. Había demostrado que el NPV era el siguiente punto clave del circuito hambre-saciedad.
Para Lowell, confirmar el lugar del NPV en el circuito era "enorme", pero seguía sin responder a la que quizá sea la pregunta más fascinante de todas: ¿cómo llegaban estas señales a las partes conscientes del cerebro, las partes que podían hacer que un animal actuara para conseguir comida? En otras palabras, ¿cómo había conseguido el hambre apoderarse de la maquinaria neuronal de aquellos ratones enloquecidos? ¿Cómo obligan los pensamientos intrusivos sobre un bocadillo de albóndigas a alguien a ponerse zapatos y abrigo y buscar uno?
Para averiguarlo, Lowell necesitaba determinar adónde conducían las señales en el NPV, con la esperanza de que si continuaba siguiendo el hilo le llevaría hasta la puerta de entrada a estructuras cerebrales de orden superior. Esto se complicaba por el hecho de que las neuronas del NPV enviaban señales a distintas zonas, como el tronco encefálico, regiones que afectan a la función tiroidea y otras.
Lowell estaba bloqueado. "Podíamos eliminar estos genes y luego medir cuánta comida comían los ratones o cómo engordaban, pero no podíamos ir mucho más allá", dice.
Un “mando a distancia” mágico
En el verano de 2009, cuatro años después del descubrimiento del NPV, Lowell estaba de visita en la Universidad Colgate, al norte del estado de Nueva York, con su hijo adolescente. Tumbado en la hierba fuera del edificio administrativo mientras su hijo hacía una entrevista de acceso, abrió el último número de la revista científica Neuron. Un artículo detallaba una nueva herramienta de laboratorio desarrollada por Bryan Roth en la Universidad de Carolina del Norte, Chapel Hill: un "mando a distancia químico-genético" que podía utilizarse para encender y apagar neuronas específicas en ratones. Lowell reconoció al instante que se trataba del gran avance que había estado esperando durante toda su carrera.
En lugar de eliminar poblaciones de neuronas de forma permanente en los ratones, Lowell pudo crear nuevas cepas de ratones criados para tener ese interruptor de control remoto genético, lo que le permitió activar y desactivar distintas poblaciones de neuronas simplemente administrando un agente químico. (Otra técnica conocida como optogenética también le permite hacer esto irradiando una longitud de onda específica de luz en el cerebro a través de un cable de fibra óptica). Así, pudo observar en tiempo real el efecto en el comportamiento de la activación y desactivación de neuronas específicas.
"De repente pude hacer cosas que cuando era estudiante nunca soñé que podría", dice.
En 2014, Lowell utilizó la herramienta de control remoto para encender y apagar metódicamente cada haz de neuronas que salen del NPV, para ver cuáles producían saciedad. Una vez identificadas las neuronas que afectaban a esta, las siguió fuera del hipotálamo. Le condujeron a una zona del tronco encefálico denominada núcleo parabraquial (PBN), el tercer nodo clave del circuito hambre-saciedad.
Fue un hito científico. Lowell había llegado por fin a una zona del cerebro con conexiones directas a estructuras cerebrales de orden superior que afectan a todos los aspectos de nuestra experiencia consciente, incluidas las áreas implicadas en la motivación, la recompensa, la emoción, el procesamiento de estímulos sensoriales, la memoria, la atención selectiva y una amplia gama de otras funciones.
En algún lugar de esa zona del cerebro estaba la última estación, las neuronas del "Santo Grial": las que finalmente le dicen al resto del cerebro "ve a comer".
A la caza del Santo Grial
Durante los últimos ocho años, Lowell y Andermann han estado buscando las neuronas del PBN implicadas en el hambre. Es una búsqueda minuciosa: el PBN contiene cientos de miles de neuronas. El laboratorio de Lowell rastrea el circuito del hambre y la saciedad desde el PBN, mientras que el de Andermann lo hace desde el la corteza insular, una zona asociada a la experiencia consciente de estados corporales como el hambre. El objetivo es llegar a un punto intermedio.
Si consiguen trazar este circuito, empezarán a examinar cómo una simple señal, la señal de que tenemos hambre, trabaja para reclutar áreas cerebrales de orden superior y las centra en la realización de una tarea. Tendrán la oportunidad de desarrollar un modelo de cómo los animales traducen el deseo en acción. En pocas palabras, podrían caracterizar una acción compleja de principio a fin.

El gran número de neuronas del PBN hace que la tarea sea desalentadora. La tarea se complica aún más por el hecho de que el PBN no sólo envía señales de hambre a los centros de procesamiento cerebral de orden superior, sino que también es la parada final de muchos otros impulsos y necesidades. Es una enorme estación de paso para todo tipo de información, la mayoría de la cual no tiene nada que ver con el hambre, como la excitación sexual, las sensaciones asociadas al dolor, la detección del calor y el frío, los picores y las náuseas, y las señales asociadas a una amplia gama de funciones autónomas, como la respiración, la presión sanguínea y la regulación de la temperatura. Es probable que cada una de estas señales tenga su propio conjunto de neuronas específicas y genéticamente distintas en el PBN. La mayoría de estas neuronas nunca se han identificado ni estudiado. Y todas parecen idénticas.
A veces, los investigadores han tenido que rastrear el camino de los impulsos nerviosos neurona por neurona, activando una neurona que saben que forma parte del circuito del hambre y la saciedad mediante tecnologías de "mando a distancia" y observando qué neuronas se encienden en respuesta. (El ADN de los ratones con los que trabaja también contiene secuencias para trazadores fluorescentes que se iluminan cuando se disparan determinadas neuronas. Esa luz puede detectarse, mediante una sofisticada tecnología de detección óptica, a través de una ventana en el cráneo y luego reproducirse en una pantalla de ordenador). Esto ha permitido a Lowell y Andermann reducir el número de neuronas candidatas que está considerando de cientos de miles a unas 10.000.
Para reducir aún más las posibilidades, Lowell dedicó tres años a clasificar estas 10.000 neuronas en diferentes subtipos utilizando sus firmas genéticas. Ha identificado 37 subtipos genéticamente distintos.
Ahora Lowell y Andermann están experimentando con un subtipo tras otro para ver cuáles intervienen en el circuito del hambre.
Para ello, exponen a ratones vivos a distintas condiciones y observan qué neuronas se activan en respuesta. Pueden ver si una neurona se dispara cuando, por ejemplo, se muestran a los ratones imágenes que han aprendido a asociar con una golosina.
Una vez identificadas las neuronas que se activan en el PBN por la señal de la comida, están utilizando otras técnicas experimentales para averiguar cuál de los 37 perfiles genéticos distintos llevan estas neuronas.
El proceso, que implica sacrificar a los ratones y diseccionar su tejido cerebral, puede ser minucioso. Pero Lowell y Andermann insisten en que se están acercando a su objetivo. Esperan que en los próximos cinco años hayan encontrado las neuronas que buscan. A partir de ahí, podrán avanzar hacia las áreas cerebrales de orden superior.
El reciente desarrollo de la nueva clase de fármacos para adelgazar —y las experiencias relatadas por los pacientes— ilustran de forma prometedora el poder que pueden tener en esas áreas los circuitos que están trazando. No sólo desaparece la sensación física de hambre, porque los fármacos parecen reducir el "punto establecido" del organismo, sino que todo lo demás que suele acompañar al hambre parece desvanecerse. Los pacientes afirman que ya no les asaltan pensamientos intrusivos sobre la comida. (Estos informes son paralelos a lo que Andermann y Lowell observan en el laboratorio. Gracias a sus técnicas de imagen neuronal, los investigadores pueden saber cuándo los ratones están pensando en señales visuales que han visto en el último minuto u hora).
Queda por ver si el trabajo de Lowell y Andermann resolverá realmente el intenso debate existente en este campo sobre cómo funcionan estos fármacos y en qué partes del cerebro actúan. Pero los investigadores esperan que, al descodificar el circuito, sus hallazgos puedan servir de base para el desarrollo de nuevas generaciones de fármacos aún más eficaces y sin efectos secundarios como náuseas, vómitos, diarrea, dolor abdominal y, en algunos casos, pancreatitis y cambios en la visión.
Aunque esto sería noticia, no es lo que más entusiasma a Lowell. Lo que más le entusiasma es la idea de que su investigación podría aportar nuevos conocimientos sobre la motivación, la toma de decisiones y muchas otras funciones, como la voluntad y la supervivencia humanas. Para ilustrar por qué está tan entusiasmado, habla de un vídeo que ha visto de una ardilla hambrienta que recorre un circuito a lo "Misión imposible" para acceder a la comida; la ardilla trepa por un poste, se lanza por el aire y aterriza en un molino de viento, y se desliza a través de una pequeña abertura en una barrera de plástico mientras cuelga boca abajo de un tendedero.
"La ardilla no actúa por reflejo", dice. "Es un entorno totalmente novedoso. Tiene que utilizar todos sus procesos superiores para lograr ese objetivo". ¿Cómo consigue este sistema tan simple hacerse con el control?
"Esa es la gran pregunta", afirma. "No sabemos cómo funciona nada de eso, esos procesos superiores".
Ahora que por fin está equipado con todas las herramientas que necesita para desenredar el vertiginosamente complejo plato de espaguetis neuronales, puede que solo sea cuestión de tiempo que lo descubra.
Adam Piore es un periodista 'freelance' que reside en Nueva York. Es autor de 'The Body Builders: Inside the Science of the Engineered Human', sobre cómo la bioingeniería está cambiando la medicina moderna.


