Un grupo de padres cuyos hijos comparten esta enfermedad genética ultrarrara y mortal recaudaron millones de euros por su cuenta para financiar la fabricación del tratamiento. El pequeño Benny Landsman ha recibido billones de partículas virales en el cerebro con copias correctas del gen que le falta
Cuando Gary Landsman reza, se imagina que está en Israel y que sus hijos Benny y Josh corren hacia él. Llevan kipá y los flecos del talit llamados tzizit se mueven en sus cinturas. El padre abre los brazos a la espera de un gran abrazo.
Pero lo cierto es que Benny y Josh tienen la enfermedad de Canavan, un trastorno neurodegenerativo, hereditario y mortal. Van abrochados en sus sillas de ruedas, no hablan y no pueden controlar sus extremidades.
El jueves 8 de abril, Landsman y su familia llevaron al hermano mayor, Benny, a un hospital en Dayton (EE. UU.) donde durante varias horas, los neurocirujanos perforaron agujeros en su cráneo e inyectaron billones de partículas virales con la versión correcta de un gen ausente en su organismo. Esa operación fue el punto culminante de la lucha de cuatro años de la familia Landsman, que vive en Nueva York (EE. UU.), para conseguir una terapia genética que creen que es la única esperanza para salvar a sus hijos.
MIT Technology Review escribió por primera vez sobre la odisea de la familia Landsman en un reportaje especial de 2018 sobre medicina de precisión. Los avances en la tecnología de la terapia génica están permitiendo tratar algunas enfermedades genéticas como la hemofilia. Pero dado que la de Canavan es una enfermedad ultrarrara, son pocas las empresas que trabajan en su cura. Por eso, la familia financió el atrevido tratamiento genético por sí misma con fondos que se recaudaron online.
Los impresionantes logros en la secuenciación del genoma, en el reemplazo de genes y en la edición genética significan, en teoría, que se podrían tratar miles de enfermedades genéticas raras. Pero, según los padres, como las empresas no se abren ese camino, se ven obligados a embarcarse en misiones multimillonarias para financiar los experimentos. Además está el dilema ético: en algunos casos, los padres están designando a sus propios hijos como los primeros destinatarios.
El ensayo clínico de Dayton, por ejemplo, está dando prioridad a los niños cuyas familias han podido recaudar fondos para financiar el experimento, cuyos costes ya se acercan a los cinco millones de euros. "Eso plantea la eterna cuestión de la igualdad de acceso a los ensayos", señala la experta en Bioética de la Universidad de Nueva York Alison Bateman-House, que estudia las cuestiones éticas en los ensayos de terapia genética pediátrica.
La familia Landsman ha recaudado más de 1,66 millones de euros, y otras familias de Rusia, Polonia, Eslovaquia e Italia también han utilizado donaciones para asegurar su sitio en el estudio. Una familia rusa incluso publicó una copia de la factura por el "tratamiento de terapia genética" por un total de 1.945.761 euros, que incluía 663.692 euros para costes de fabricación del tratamiento genético usado en el estudio.
Según el llamamiento urgente de recaudación de fondos de la familia rusa, si no pagaban esa cantidad, su pequeña Olga "no tendrá esta única oportunidad de recuperarse: el tratamiento costoso en Estados Unidos". Terminaron aportando al menos 580.730 euros.
Aunque estos ensayos clínicos de "pagar por participar" son legales, generan señales de alerta, incluidas las dudas sobre si los padres y los donantes entienden que la mayoría de los tratamientos experimentales fracasan. "No son necesariamente poco éticos. Pero hay que analizar a fondo por qué se le pide al paciente que pague. Si es un ensayo válido, ¿por qué no están interesados los NIH [Institutos Nacionales de Salud] o alguna empresa de biotecnología? ¿Por qué no hay otro tipo de financiación?", resalta Bateman-House.
¿Funcionará?
La enfermedad de Canavan se produce cuando un niño hereda dos copias rotas de un gen llamado ASPA. Sin la enzima que produce ASPA, el cerebro no puede formar correctamente los haces de nervios que transmiten las señales en el cerebro. El resultado, en el caso de Benny y Josh, es que no pueden hablar ni controlar sus extremidades y su cognición es limitada.
"Son como bebés en cuerpos de ELA", explica la investigadora de la Universidad Rowan en Nueva Jersey (EE. UU.) Paola Leone, que ideó la terapia génica y dirigió el esfuerzo para iniciar el ensayo clínico.

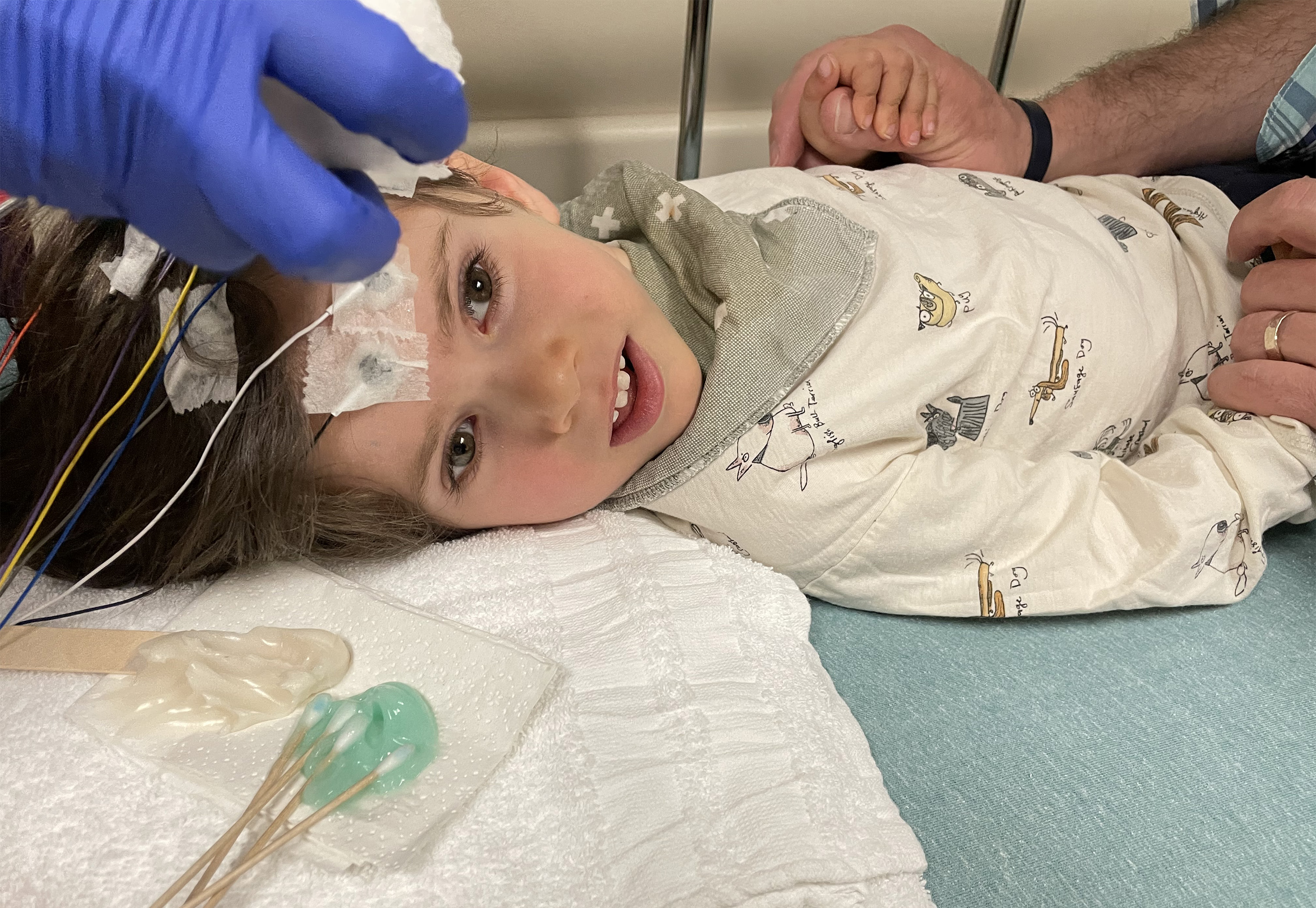
Foto: Benny Landsman llegó al Hospital Infantil de Dayton el 8 de abril, donde se convirtió en el primer niño en recibir una nueva terapia genética para la enfermedad de Canavan. Crédito: Cortesía de Jennie Landsman

Foto: Jennie y Gary Landsman con Benny. La familia Landsman recaudó más 1,66 millones de euros en donaciones para financiar el desarrollo de un tratamiento de reemplazo genético. Crédito: Cortesía de Jennie Landsman
El ensayo clínico en Dayton usa virus para entregar copias funcionales del gen ASPA al tejido cerebral de los niños. Eso es lo que ocurrió el pasado 8 de abril en el Hospital Infantil de Dayton. Después de que Benny fuera recibido por un perro golden retriever que anima a los pacientes, los neurocirujanos perforaron su cráneo y luego usaron una aguja para introducir 40 billones de partículas de virus.
La apuesta científica de Leone es que, al añadir copias correctas de ASPA a las células cerebrales específicas llamadas oligodendrocitos, se podría detener el desarrollo de la enfermedad y tal vez permitiría cierta recuperación. El tratamiento ha sido eficaz en ratones, pero "¿funcionará en humanos? La única forma de saberlo consiste en probarlo", afirma la científica.
Padres convertidos en científicos
En la actualidad, hay media docena de ejemplos de tratamientos de terapia genética financiados por las familias con el objetivo de tratar a sus propios hijos, y se planean aún más experimentos de este tipo. Los científicos incluso han comenzado a desarrollar medicina hiperpersonalizada adaptada a niños individuales que padecen problemas genéticos únicos.
Estos esfuerzos desesperados exigen a los padres que superen algunos obstáculos casi imposibles. Deben convertirse en expertos en el desarrollo de fármacos, recaudar millones de euros y engatusar incansablemente a los científicos. Pocas personas pueden conseguirlo.
"Hay mucha gente que sabe cómo realizar la terapia génica, pero el conocimiento está fragmentado y muchas cosas pueden salir mal", reconoce el desarrollador de software Sanath Kumar Ramesh, cuyo hijo padece una enfermedad rara diferente. Ramesh fundó la organización Open Treatments que desarrolla software que las familias pueden usar para organizar la investigación de la terapia génica, incluida la contratación de los científicos para crear modelos de alguna enfermedad en animales.
Y añade: "Creo que, en el futuro, la distinción entre los científicos y los padres será difusa".
Para los padres cuyos hijos ya han sido aceptados en el ensayo de Dayton, la terapia genética puede ser su última oportunidad. Una de ellos es la técnica de uñas Meagan Rockwell, cuya hija, Tobin Grace, ahora tiene tres años y medio, y fue diagnosticada con Canavan en 2018. La madre afirma: "Nos dijeron que lo sentían, que no había nada que podían hacer, ningún tratamiento, ninguna cura. Sería una gran suerte si llegara a cumplir cinco años. Fue un duro golpe saber que mi única hija tenía una enfermedad cerebral mortal".
Rockwell se enteró del esfuerzo de terapia genética de Leone por internet y logró recaudar más de 200.000 euros. "En ese momento, Tobin era la persona más joven en EE. UU. con Canavan, y creo que eso fue un gran factor en su aceptación", opina, y añade que Leone explica a los padres que el dinero los pone al principio de la lista, pero no garantiza el tratamiento.
Bateman-House señala que otro riesgo es la duda de si los padres realmente pueden juzgar los beneficios de un tratamiento experimental de una manera "desapasionada", especialmente si han invertido una fortuna. "No es solo que su hijo se enfrente a una enfermedad peligrosa; sino que su sangre, sudor y lágrimas es lo que financia esta intervención. Podría ser increíblemente difícil para unos padres cambiar de opinión y decir 'No vamos a hacerlo'", explica.
Esperanza frente a riesgo
El estudio de Dayton actualmente solo cuenta con suministros del fármaco genético suficientes para tratar a nueve o diez niños. Se fabricó en España, pero los investigadores y las familias tuvieron que superar lo que ellos llaman un calvario de trámites burocráticos, retrasos y obstáculos, algunos de los cuales fueron creados por los reguladores gubernamentales que deciden qué tratamientos genéticos se pueden probar y si los ensayos se planifican adecuadamente.
En 2019, los Landsman llevaron a sus hijos a la Administración de Medicamentos y Alimentos de EE. UU. para una reunión que consiguieron después de docenas de llamadas. Jennie Landsman recuerda: "A priori éramos un número de un caso más en su gran pila de papeles. Tenían objeciones muy técnicas. En esa reunión levantamos a Benny y Josh y dijimos: 'Esperamos que este problema tan técnico no detenga el tratamiento'".
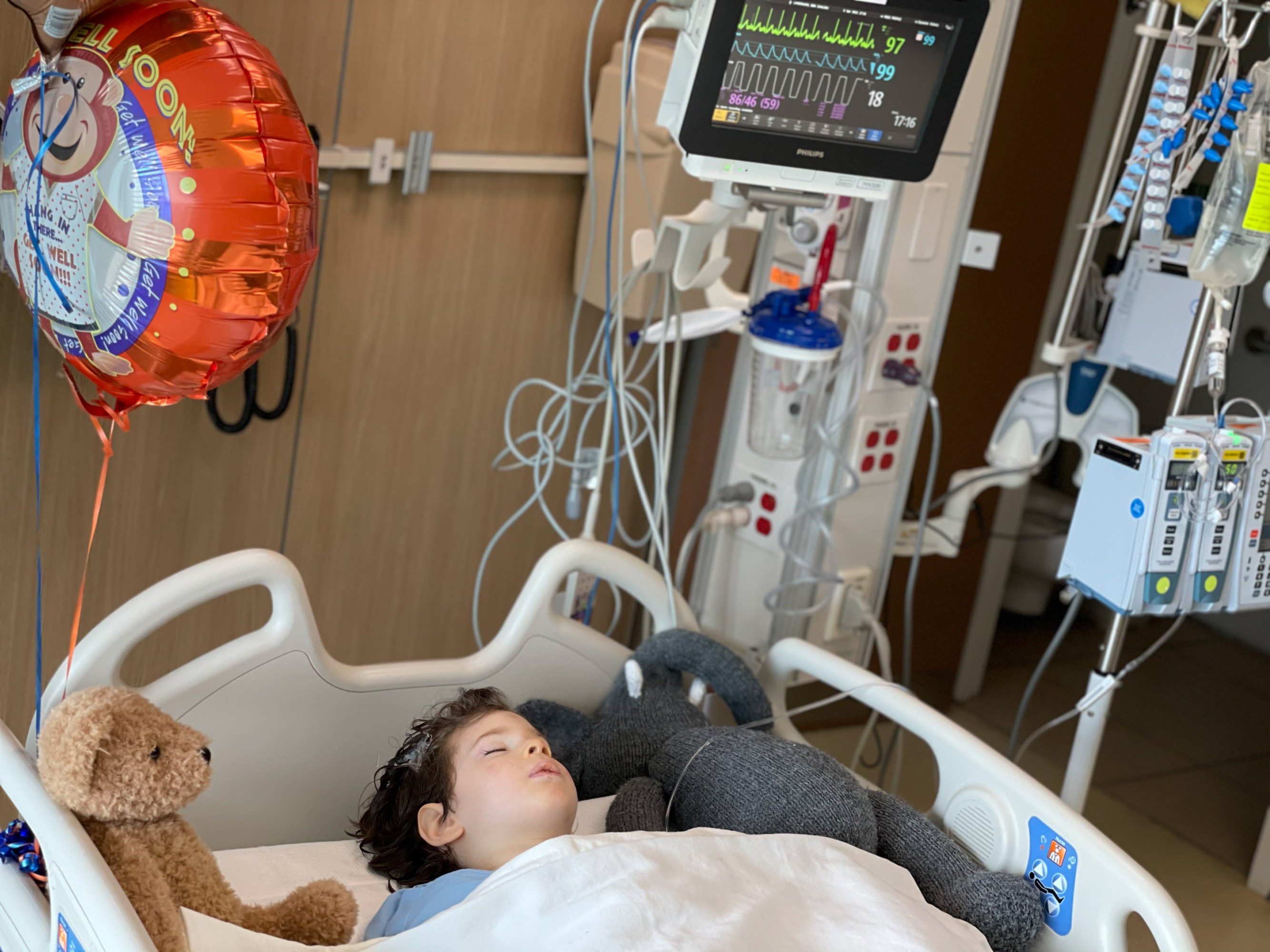
Foto: Benny Landsman y su hermano menor Josh padecen la enfermedad de Canavan, un trastorno hereditario mortal. En abril, Benny fue sometido a un tratamiento de terapia génica en un intento de añadir un gen corregido a sus células cerebrales. Crédito: Cortesía de Jennie Landsman
El estudio de Dayton recibió luz verde en diciembre y comenzó apenas a tiempo para Benny, quien alcanzará el límite de edad de cinco años en junio. "Benny es la prueba piloto. Es el niño con el que decimos: 'Dios, esperamos que esto funcione'", admite Rockwell, quien aún no tiene una fecha definitiva para la operación de su hija.
¿Cuál es la probabilidad de que la terapia funcione? Las técnicas de reemplazo genético han tenido un éxito notable, curando a niños que no tienen sistema inmunológico y previniendo enfermedades cerebrales. Desde 2017, también se aprobó la venta de una pequeña cantidad de terapias genéticas en EE. UU., a precios tan altos como 2,1 millones de dólares (1,74 millones de euros) por niño.
Los precios récord han despertado el interés entre las empresas biotecnológicas especializadas, que ahora ven un negocio incluso en las enfermedades superraras. Aspa Therapeutics afirma que tiene planes de iniciar un ensayo diferente de la terapia génica para Canavan. Su CEO, Eric David, estima que hay 1.000 niños vivos con esta enfermedad en Estados Unidos y Europa. Y afirma: "Para nosotros, eso es suficiente".
No hay certeza de que la terapia genética tenga éxito en la enfermedad de Canavan. Incluso si el gen corregido detiene el desarrollo de la enfermedad, es posible que el cerebro de los niños ya haya sufrido daños irreversibles.
Pensando en su hija, Rockwell admite: "Espero que se pueda sentar sola, que quizás diga mamá y papá. Tengo esperanzas, pero es puramente experimental. Estamos entregando a nuestros bebés a la ciencia y esperamos y rezamos para que funcione". Pasará un mes antes de que los médicos sepan si el nuevo gen funciona en el cerebro de Benny, pero probablemente hará falta mucho más tiempo para detectar si tiene algún efecto sobre sus síntomas.
En un mensaje a los donantes, Gary Landsman respondió a lo que se refirió como la pregunta "capciosa" de lo que espera que logre el tratamiento. Y afirmó: "He reflexionado sobre esta pregunta una y otra vez. ¿Está bien querer más? ¿Está bien querer cogerlos de la mano mientras caminan a mi lado? ¿Está bien querer escucharlos como hablan conmigo? Quizás esté jugando un juego peligroso en mi mente. Pero creo que vale la pena correr ese riesgo por la esperanza que eso ofrece".


