Médicos de Nueva York (EE. UU.) van a probar un tratamiento basado en la administración de virus con la variante genética ApoE2, que reduce el riesgo de sufrir la enfermedad de Alzheimer, en el cerebro de aquellas personas con más posibilidades de padecerla. Si el ensayo es un éxito, abrirá una puerta a la prevención
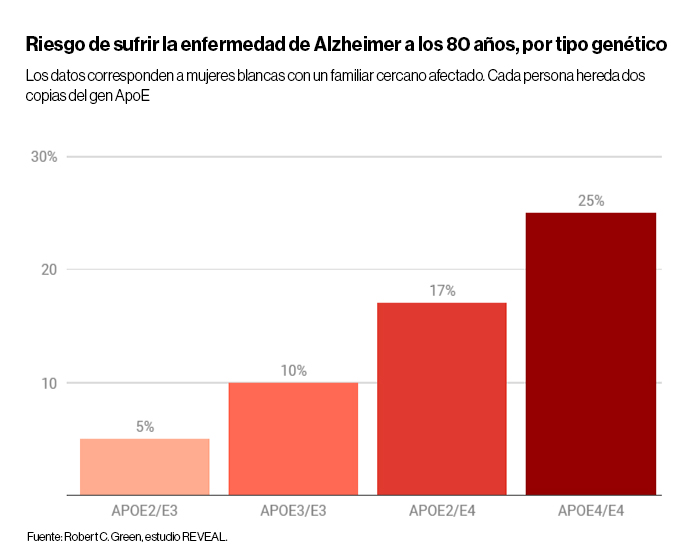
Nadie sabe con certeza qué provoca la enfermedad de Alzheimer. Pero un hecho sobre ella es casi indiscutible. Dependiendo de la variante que heredemos de un gen llamado ApoE, nuestro riesgo de sufrir este trastorno cerebral podría ser la mitad de la media o más de 12 veces mayor.
Llamado en ocasiones "el gen del olvido", el ApoE tiene tres variantes comunes, llamadas 2, 3 y 4. El tipo 2 reduce el riesgo de una persona, el 3 es el promedio y el 4 aumenta la posibilidad drásticamente. El riesgo es tan grande que los médicos evitan hacer pruebas de ApoE porque un mal resultado puede afectar mucho a las personas y no hay nada que hacer al respecto. No hay cura y tampoco podemos cambiar nuestros genes.
Bueno, no podemos cambiarlos por ahora. Algunos médicos en la ciudad de Nueva York (EE.UU.) afirman que a partir de mayo comenzarán a realizar ensayos de una nueva terapia génica en la que a personas con la peor versión de ApoE se les administrará una dosis enorme de la versión del gen de bajo riesgo en el cerebro.
Si eso desacelera la enfermedad que desgasta el cerebro en las personas que ya tienen alzhéimer, con el tiempo eso podría llevar a una forma de prevenir esta enfermedad. El ensayo clínico, dirigido por el investigador en el Weill Cornell Medicine en Manhattan (EE.UU.), Ronald Crystal es una novedosa táctica contra la demencia y un nuevo giro para la terapia genética. La mayoría de los intentos de reemplazar genes, que dependen de los virus para llevar las instrucciones de ADN a las células de una persona, tienen como objetivo corregir enfermedades raras como la hemofilia reemplazando un único gen defectuoso.
Pero las enfermedades comunes no tienen causas únicas, por lo que la terapia génica nunca se había visto como prometedora. La Alianza para la Medicina Regenerativa (The Alliance for Regenerative Medicine en inglés), un grupo comercial, sostiene que no conoce terapias genéticas que se estén probando actualmente en pacientes con la enfermedad de Alzheimer.
"Empezar con los ensayos clínicos en humanos parece una apuesta arriesgada, pero existe una necesidad desesperada de cualquier tratamiento", opina el profesor de la Escuela de Medicina de la Universidad de Pensilvania (EE.UU.) Kiran Musunuru. Él estudia los tratamientos genéticos para las enfermedades del corazón y cree que el experimento planeado en Nueva York representa una nueva categoría de terapia génica en la que el objetivo no es curar, sino "reducir el riesgo de futuras enfermedades en personas sanas".
Crystal destaca que su plan también evita el debate sobre la verdadera causa de la enfermedad de Alzheimer, que se ha convertido en una ruleta multimillonaria en la que las compañías farmacéuticas y los pacientes siguen perdiendo. En enero, Roche canceló dos grandes estudios de un anticuerpo destinado a eliminar las placas características de una proteína llamada beta-amiloide, en el que fue el último golpe a la teoría de que estas placas alrededor de las neuronas son la causa fundamental del alzhéimer.

"Existen personas de nuestro campo que creen seriamente que el amiloide es la solución", defiende Crystal, mientras que algunos piensan que está en otra proteína llamada tau que se encuentra en las neuronas moribundas. "Probablemente la respuesta es que se trata de algo muy complejo", sigue él. "El enfoque que aplicamos era ignorar todo eso y pensar sobre ello desde un punto de vista genético".
Al hacerlo, el equipo de Crystal confía en un descubrimiento de 25 años. En la década de 1990, los investigadores de la Universidad de Duke buscaban cualquier proteína que pudieran encontrar añadida a las placas amiloides. Identificaron la apolipoproteína E, la proteína codificada por el gen ApoE. Al secuenciar el gen en 121 pacientes, determinaron que una versión, ApoE4, era inexplicablemente común en los que padecían la enfermedad.
La función del gen aún no se comprende completamente (tiene un papel en el transporte de colesterol y grasas), pero su condición como factor de riesgo sigue siendo temible. Según la Asociación de Alzheimer, aproximadamente el 65 % de las personas con alzhéimer tienen por lo menos una copia de este gen de riesgo. Para las personas que nacen con dos copias de alto riesgo, una de cada padre, la demencia se convierte en algo casi seguro si viven lo suficiente.
Sin embargo, algunas personas heredan un tipo 4 y un tipo 2, la versión de menor riesgo del gen. Esos individuos tienen un riesgo más cercano a la media, lo que sugiere que la versión protectora del gen está compensando el riesgo.
Este es el efecto que los médicos de Weill Cornell intentarán copiar. Ahora, el centro está buscando a personas con dos copias del gen de alto riesgo que ya sufren pérdida de memoria, o incluso tienen ya el diagnóstico de que es la enfermedad de Alzheimer. Según Crystal, cuando empiecen dentro de unos días, los primeros voluntarios recibirán en sus médulas espinales una inyección de miles de millones de virus que llevan el gen del tipo 2.
Basándose en las pruebas en monos, Crystal espera que los virus extiendan el gen de menos riesgo a las células de todo el cerebro de los pacientes. Este centro médico descubrió que los ratones tratados de la misma manera acumularon menos amiloide en sus cerebros.
La estrategia, según señala Crystal, no se basa en saber todo sobre lo que realmente causa la enfermedad. "Lo que nos atrae de la enfermedad de Alzheimer es que la epidemiología genética es tan obvia", afirma. "Así que la estrategia es, ¿podemos bañar el cerebro en E2? Tenemos la infraestructura para hacerlo, así que pensamos, ¿por qué no? Eso evita el problema del mecanismo de la enfermedad".
"El concepto es racional", añade Crystal. "Pero si funciona en humanos es otra cosa".
El estudio de Nueva York es preliminar. Crystal explica que su equipo debe determinar incluso si el gen añadido funciona a un nivel detectable. Los médicos extraerán el líquido cefalorraquídeo de los pacientes y verán si contiene la esperada combinación de proteínas: el tipo 4 esperado, pero ahora con una cantidad igual o mayor del tipo 2 añadida.
Cuando las personas comienzan a olvidar los nombres y dónde dejaron las llaves del coche, es el resultado de cambios cerebrales que empezaron una década antes. Eso significa que los pacientes que se unen al ensayo no pueden esperar mucho. Probablemente sea demasiado tarde para ellos.
Aun así, la Alzheimer's Drug Discovery Foundation (Fundación para el Descubrimiento de Fármacos para el Alzhéimer) le ha concedido a Crystal 2,6 millones de euros para pagar el estudio clínico, su mayor donación hasta la fecha. "Aún no sabemos qué sucederá", dice el director adjunto de esta fundación, Nick McKeehan. "Pero es un paso importante. Tal vez tengamos que tratar a las personas antes. Abriremos la puerta a este tipo de terapia".
Al final, la esperanza es que las personas de mediana edad con genes de riesgo puedan someterse a arreglos genéticos únicos. Incluso una pequeña reducción en el ritmo al que ocurren los cambios cerebrales podría marcar la diferencia con el tiempo.
"La enfermedad de Alzheimer es la más temida del mundo, porque perder la cabeza es horrible. Algunas personas preferirían tener cáncer o sufrir un infarto", asegura la asesora genética Susan Hahn, que cree que las personas no deben someterse a una prueba de detección del gen ApoE si no hay buenas razones para ello. "Hay que estar preparado para lo que nos van a decir, porque será para siempre. No podemos cambiar nuestros genes, aunque quizás con este estudio eso sea posible".


