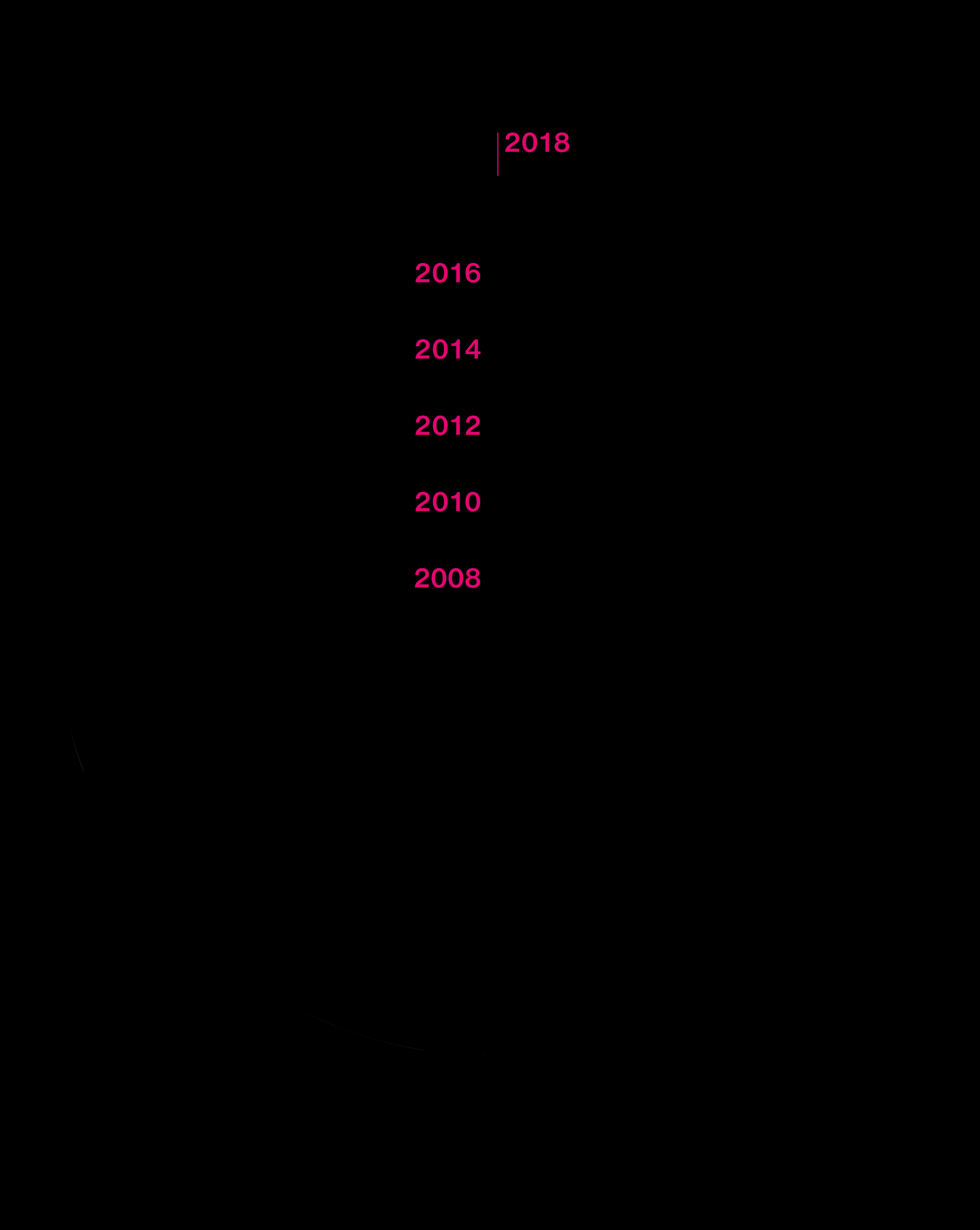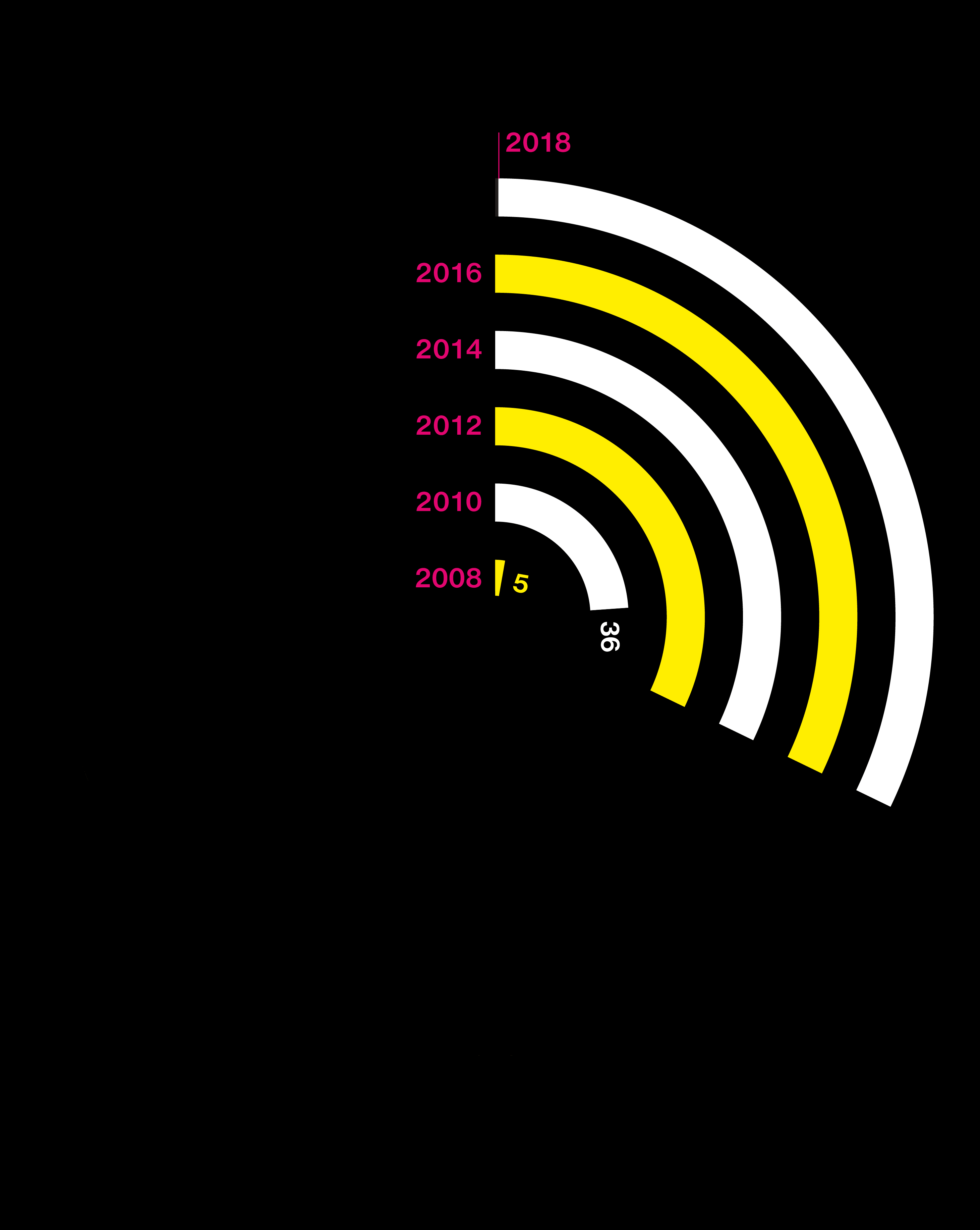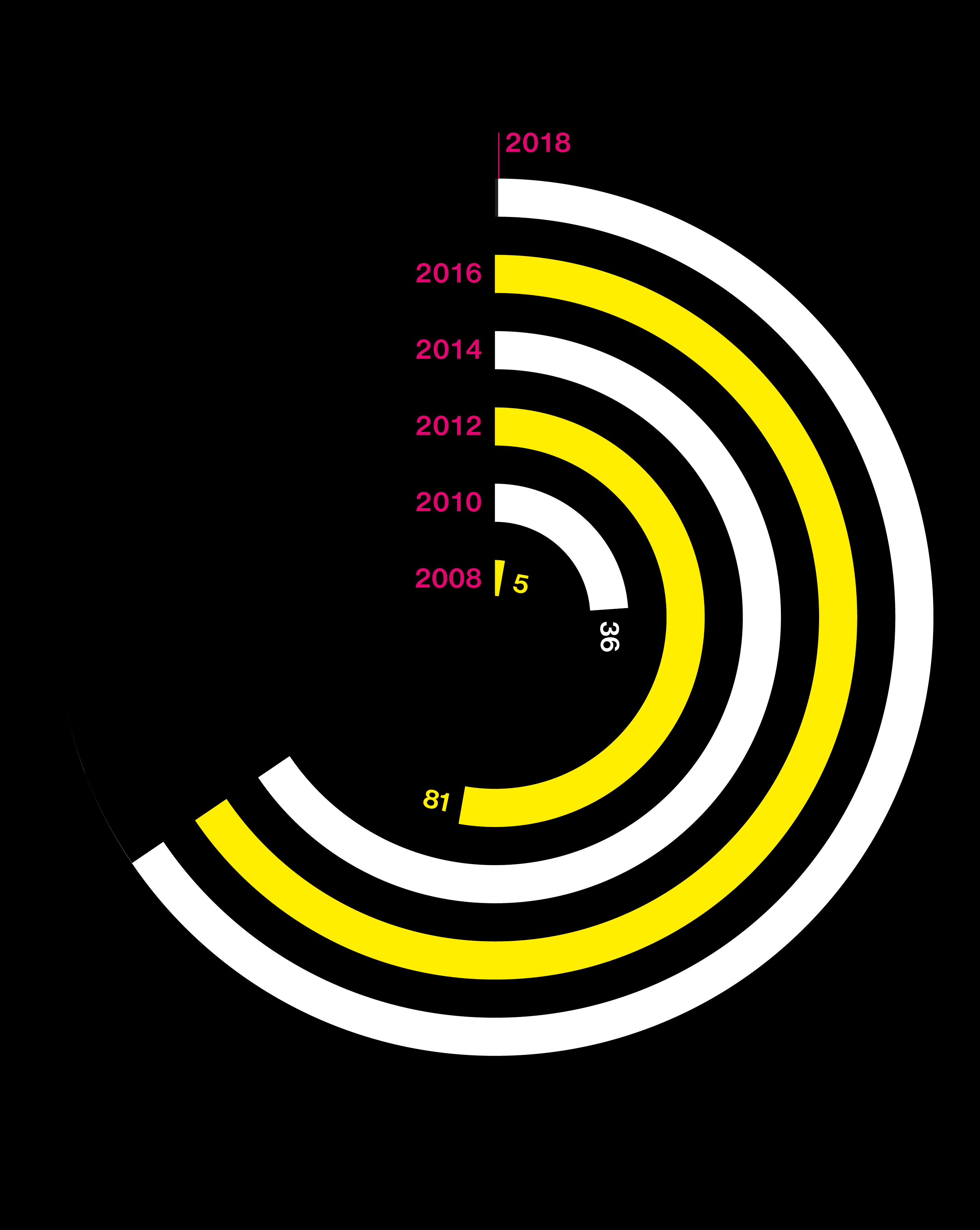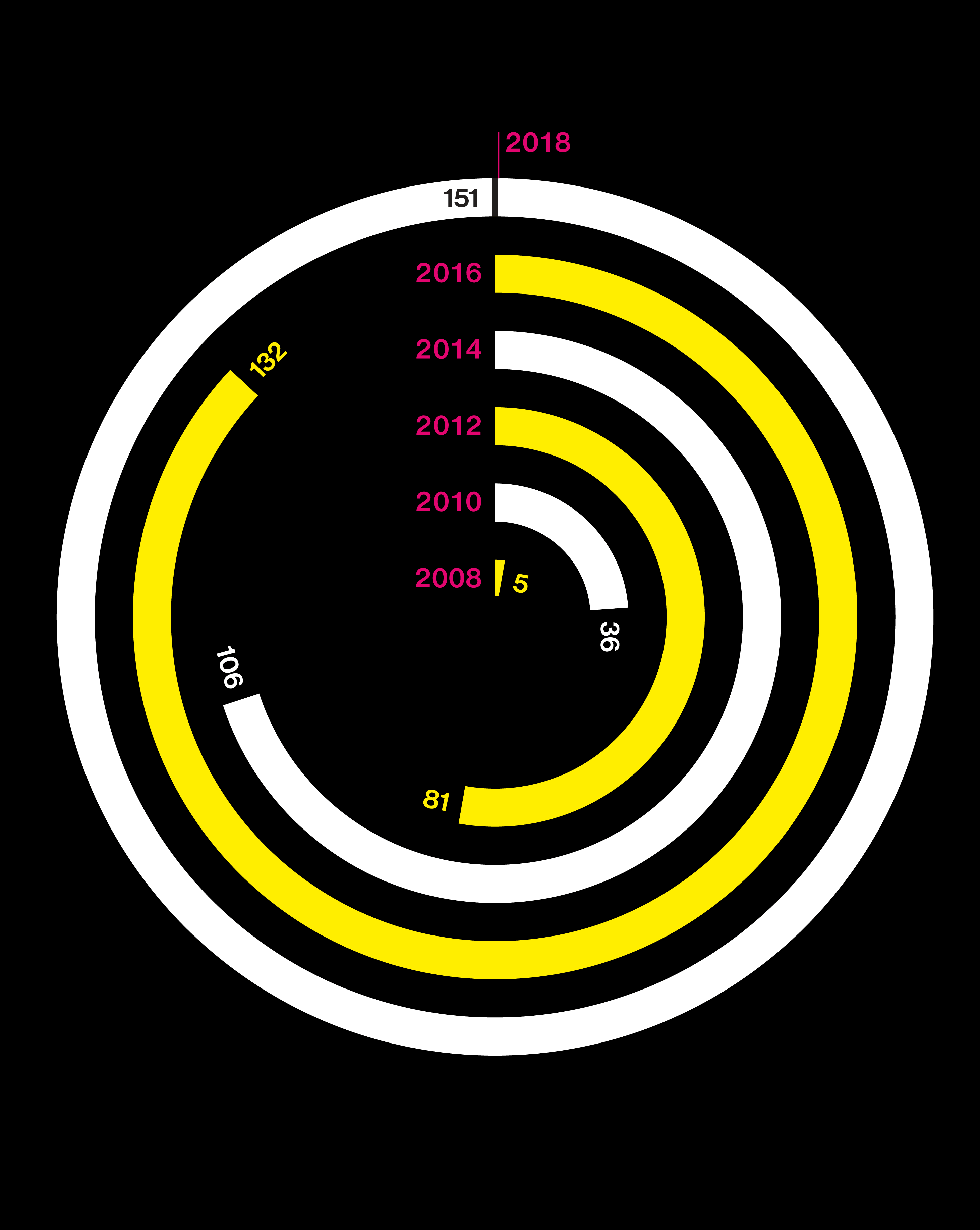
Algunos críticos consideran que la medicina de precisión está avanzando a un ritmo lento respecto al que se esperaba hace dos décadas. Sin embargo, poco a poco han aparecido cada vez más tratamientos que tienen en cuenta nuestros genes
El otoño pasado, el número de personas que habían escupido en un tubo y habían enviado su ADN a las empresas más grandes de pruebas de ADN, como Ancestry y 23andMe, probablemente superó los 20 millones. Si usted acaba de ponerse al tanto, esta cifra probablemente le parecerá enorme. Y probablemente se pregunte, ¿cómo hemos llegado hasta aquí?
Lo cierto es que ha sido poco a poco. El número de personas que reciben informes de ADN se ha casi duplicado cada año desde 2010. Las cifras aumentan en un millón cada mes y los repositorios de ADN son tan grandes que están usando unas nuevas aplicaciones sorprendentes. Los usuarios están recibiendo predicciones científicas sobre si quedarán calvos o tendrán cáncer. Los investigadores han comenzado a usar datos de ADN de estos usuarios para capturar a los delincuentes. Se están llevando a cabo enormes búsquedas de genes para descubrir las causas del insomnio y de la inteligencia.
Y el pasado verano 23andMe firmó un acuerdo de 265 millones de euros con la compañía farmacéutica GlaxoSmithKline para desarrollar medicamentos personalizados, comenzando con los tratamientos para la enfermedad de Parkinson. La idea es que podrían ayudar al pequeño grupo de pacientes de Parkinson con un error genético particular, que 23andMe puede encontrar fácilmente en su base de datos.
Desde el Proyecto del Genoma Humano (una iniciativa de 13 años y 2.645 millones de euros para descifrar el código genético humano) investigadores y médicos han estado prediciendo la llegada de la "medicina de precisión". Es un término sin una definición acordada, aunque sugiere claramente los tipos de medicamentos que Glaxo y 23andMe están buscando: más orientados a cada paciente y más efectivos porque tienen en cuenta la composición genética particular de una persona. El entonces presidente de EE. UU. Bill Clinton señaló en la presentación del primer borrador del genoma en junio de 2000 que los datos "revolucionarían el diagnóstico, la prevención y el tratamiento de la mayoría de las enfermedades humanas, si no de todas".
En busca de los mejores fármacos
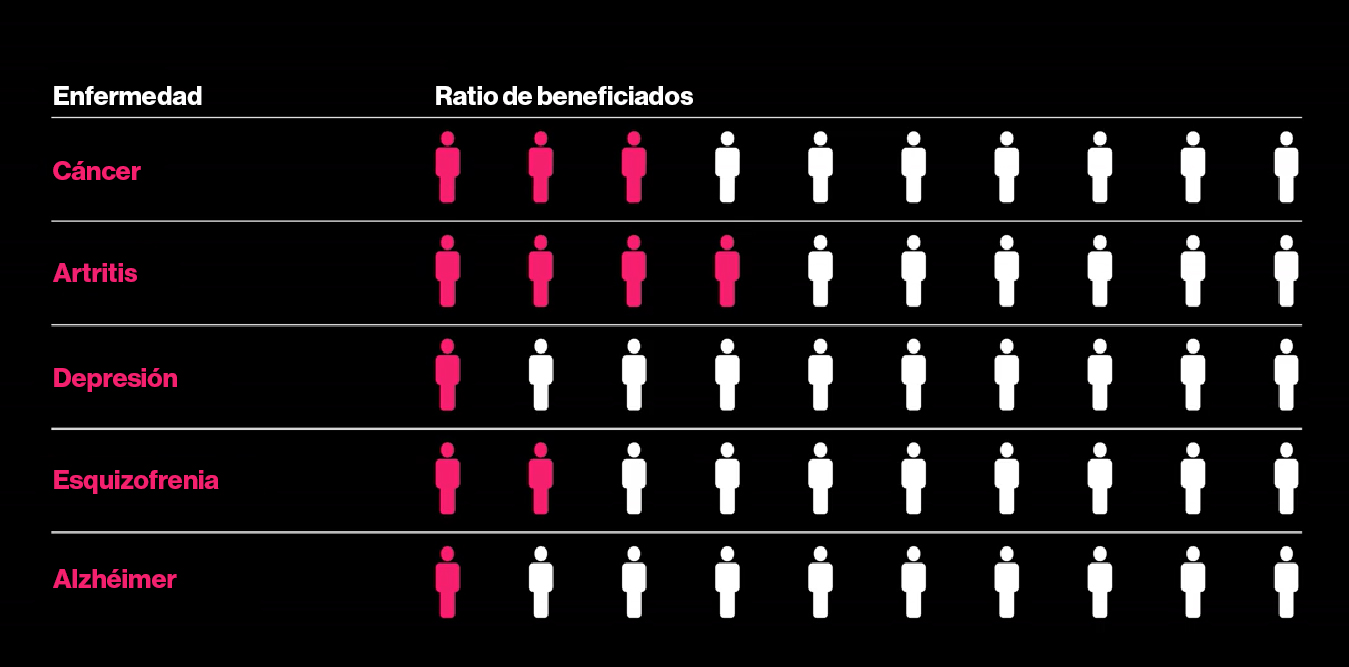
Gráfico: ratio de pacientes que se benefician del mejor fármaco en cada categoría. Fuente: Schork, Nj. Nature, Pubmed
Casi dos décadas después de esas grandes promesas, está de moda preguntarse por qué la medicina de precisión no ha dado más de sí. Un informe en The New York Times del pasado verano afirma que las muertes por cáncer aún sobrepasan a las curas por un amplio margen y planteó la pregunta: "¿nos están engañando acerca de la medicina de precisión?" Una razón para este progreso aparentemente lento es que no toda la medicina de precisión implica el uso de fármacos.
Aunque la búsqueda de genes es cada vez mayor (los últimos datos muestran comparaciones de más de un millón de registros de ADN y de informes médicos) ha surgido un hecho inconveniente sobre muchas enfermedades comunes: no tienen, en general, causas únicas. En lugar de eso, numerosos cientos de genes tienen un pequeño papel y no existe un punto obvio para intervenir con una pastilla.
Entonces, en lugar de medicamentos, estamos viendo una nueva ciencia predictiva en la que los perfiles de riesgo genético pueden sugerir qué personas deberían disminuir su presión arterial, cuáles deberían prepararse para el alzhéimer y qué pacientes de cáncer no se beneficiarán de la quimioterapia y podrían evitar el calvario.
Sin embargo, este tipo de pronósticos no son ampliamente aceptados, y es difícil lograr que las personas cambien su comportamiento. Pese a ello, para muchas personas estas predicciones pueden empezar a ofrecer una ruta concreta hacia la salud de la precisión y un mayor conocimiento de su propia biología.
El estallido de la información genética
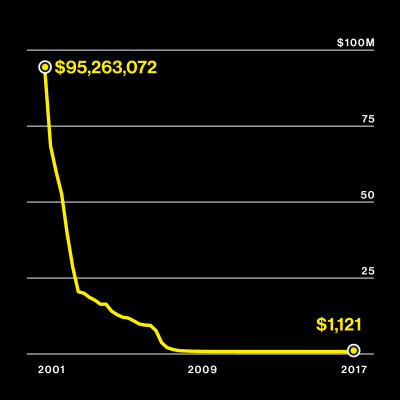
Gráfico: coste de secuenciar un genoma (en dólares). Fuente: Company Reports, Leah Larkin, ISOGG

Gráfico: número de personas que han comprado test de ADN. Fuente: Company Reports, Leah Larkin, ISOGG
Si miramos más allá del cáncer, veremos que sí han llegado algunas curas definitivas. Al igual que ocurre con esa creciente cantidad de millones de personas que analizan su ADN, es fácil no darse cuenta del cambio cuando aún no está en todas partes.
Se pueden destacar al menos dos medicamentos de importancia: los que curan la hepatitis C en el 90 % de los pacientes que lo toman y la terapia génica experimental que cura la atrofia muscular espinal, una enfermedad infantil rara, mortal y previamente no tratable. Si bien estos tratamientos provienen de diferentes rincones de la biología, lo que tienen en común es lo importante: cada uno se beneficia de la comprensión detallada de la información genética y de las herramientas para su control.
En nuestra opinión, estos fármacos muestran una precisión real. La pastilla para la hepatitis C, llamada Sovaldi, consiste en una sustancia química que no puede resistirse al virus que se reproduce. Pero cuando el medicamento entra en contacto con el genoma del virus, la reproducción se detiene.
Por su parte, el tratamiento para la atrofia muscular espinal es una parte de reemplazo genético. Con la terapia génica, los médicos pueden añadir nuevas instrucciones de ADN a las células nerviosas del niño. La docena de niños que han recibido la terapia a una edad temprana no desarrollaron la enfermedad.

Todo esto es incluso anterior al Proyecto Genoma Humano. Recordemos el acto fundacional de la industria de la biotecnología, hace 40 años. El 6 de septiembre de 1978, Genentech anunció "la exitosa producción de insulina humana en un laboratorio". Anteriormente a ello, los diabéticos habían usado la insulina de cerdos. Se necesitaba alrededor de dos toneladas de partes de cerdo para extraer ocho onzas (227 gramos) de insulina pura. Pero Genentech descubrió una manera de sintetizar la versión humana del gen productor de insulina a partir de la bacteria E. coli, que después fabricaba la hormona. Genentech aún mantiene en su página web el comunicado de prensa de hace 40 años.
Para las empresas farmacéuticas del siglo XX, que tenían sus raíces en la fabricación de colorantes comerciales y la química sintética, estos nuevos medicamentos biotecnológicos parecían al principio un espectáculo secundario. Eran difíciles de fabricar y de tomar (por inyección, en su mayoría). Los gigantes farmacéuticos podían creer que su forma de hacer las cosas siempre sería la que dominara.
Hasta bien entrada la década de 1990, una única compañía farmacéutica, Merck, tenía una valoración de mercado mayor que la del resto de compañías de biotecnología juntas. Probablemente parecía que la biotecnología nunca llegaría, hasta que llegó.
De los 10 medicamentos más vendidos en EE. UU. durante 2017, siete (incluido el de la mayor venta, el medicamento contra la artritis Humira) son medicamentos biotecnológicos basados en anticuerpos. Los anticuerpos también representan la precisión biológica. Estas diminutas proteínas de la sangre, que normalmente forman parte de nuestra respuesta inmunitaria, se ajustan como una llave en una cerradura a otras moléculas. Por ejemplo, aquellas que llegan a la superficie de una célula cancerosa. Y al igual que la insulina, a menudo se crean utilizando el código de ADN extraído de nuestros cuerpos.
Fármacos basados en el ADN
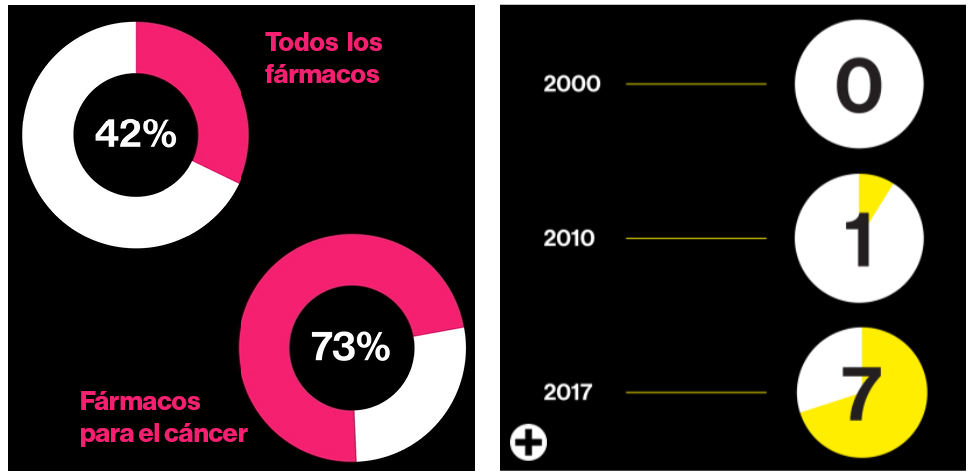
Gráfico a la izquierda: Porcentaje de fármacos en desarrollo que podrían ser personalizados para el perfil genético de una persona. A la derecha: número de los fármacos mejor vendidos en EE. UU. que son moléculas biológicas. Fuente: Tufts, Personalized medicine coalition, MIT Technology Review
La insulina y los anticuerpos están diseñados para funcionar de la misma manera en todos los humanos. Pero no existen dos personas con los genomas exactamente iguales: aproximadamente el 1% de las bases de ADN son diferentes entre cualquiera de nosotros. Esas diferencias pueden explicar por qué una persona está enferma y otra no, o por qué la versión de diabetes de una persona es diferente de la de otra. Los medicamentos que toman en cuenta estas diferencias en la información genética se denominan tratamientos "dirigidos".
El medicamento contra el cáncer Herceptin, un anticuerpo que llegó al mercado en 1998, fue uno de los primeros. Resultó efectivo, pero principalmente en personas cuyo cáncer de mama recién diagnosticado estaba creciendo debido a un daño genético específico (aproximadamente el 20% de los casos). Así que dependía del genoma del propio tumor. Herceptin llegó al mercado con la advertencia de que, para obtenerlo, primero se debía hacer una prueba para ver si la persona se obtendría algún beneficio con él. Según el Instituto Nacional del Cáncer (EE. UU.), en la actualidad hay en el mercado más de 80 medicamentos específicos de este tipo contra el cáncer.
Los críticos argumentan con razón que esos medicamentos todavía hacen muy poco para muy pocas personas a un precio demasiado alto (más de 8.000 euros al mes a menudo). De hecho, aquellos que sobreviven al cáncer, en general, no se lo deben a los tratamientos dirigidos.
"El único y mejor determinante de quién sobrevive al cáncer es saber quién tiene seguro [médico]", dijo el líder de la Biden Cancer Initiative, Greg Simon, y no si existe un medicamento que coincida con su mutación. Algunos piensan que pasamos demasiado tiempo buscando la luz de las lámparas genéticas. "Tal vez nos había seducido la tecnología de la secuenciación de genes, por la pura magia de poder observar el núcleo genético de un cáncer", escribió este verano el médico ganador del premio Pulitzer, Siddhartha Mukherjee.
Las grandes preguntas necesitan 'big data'
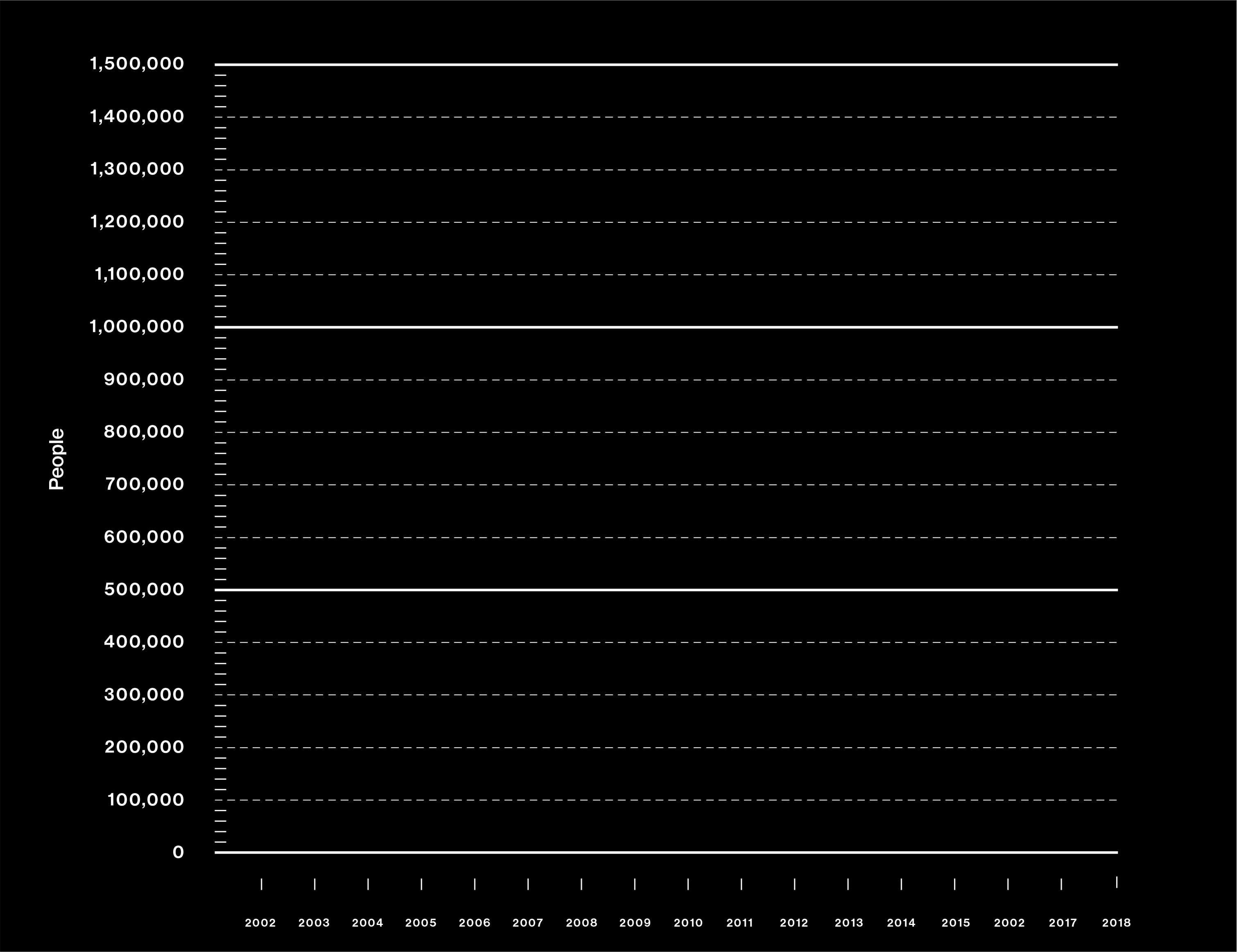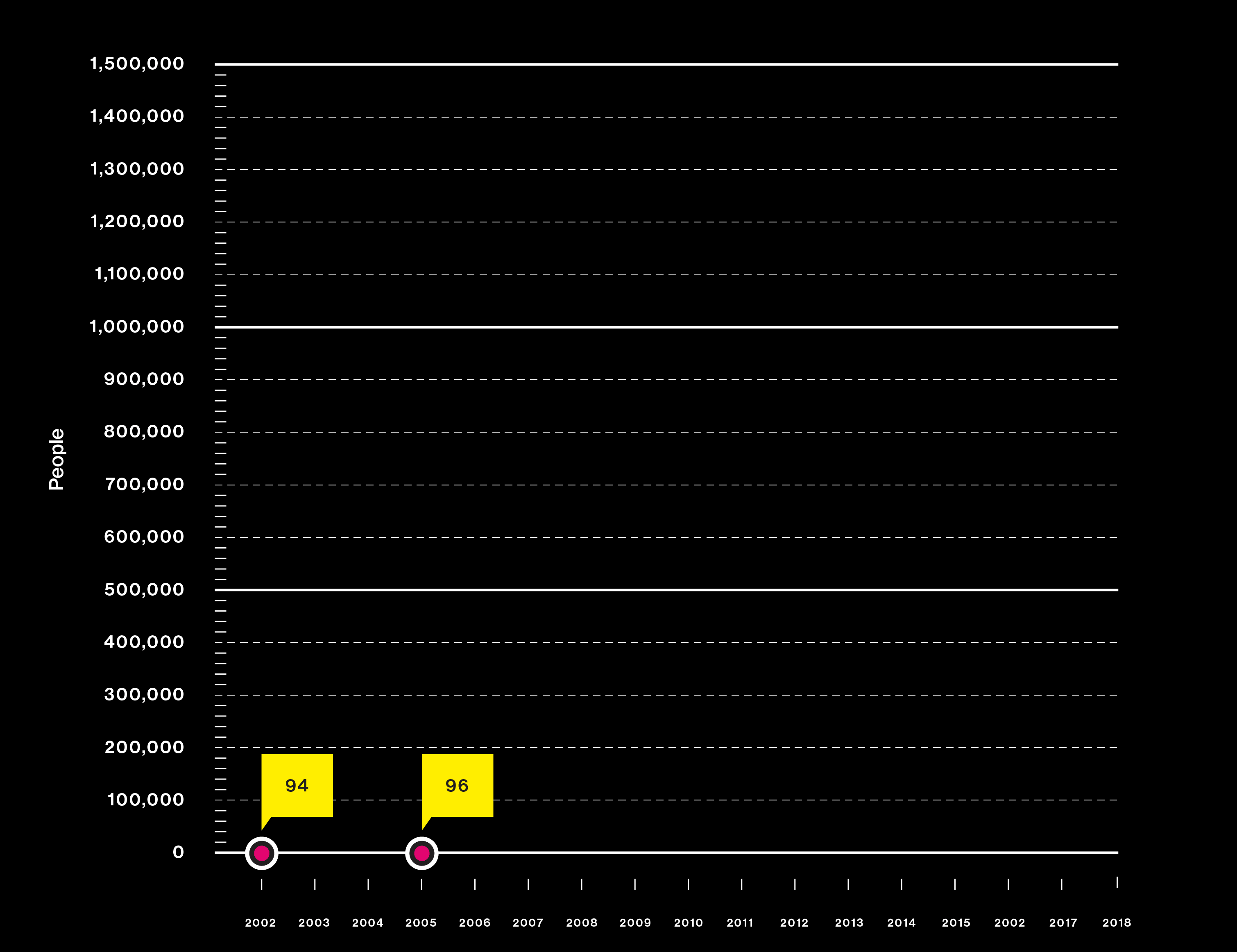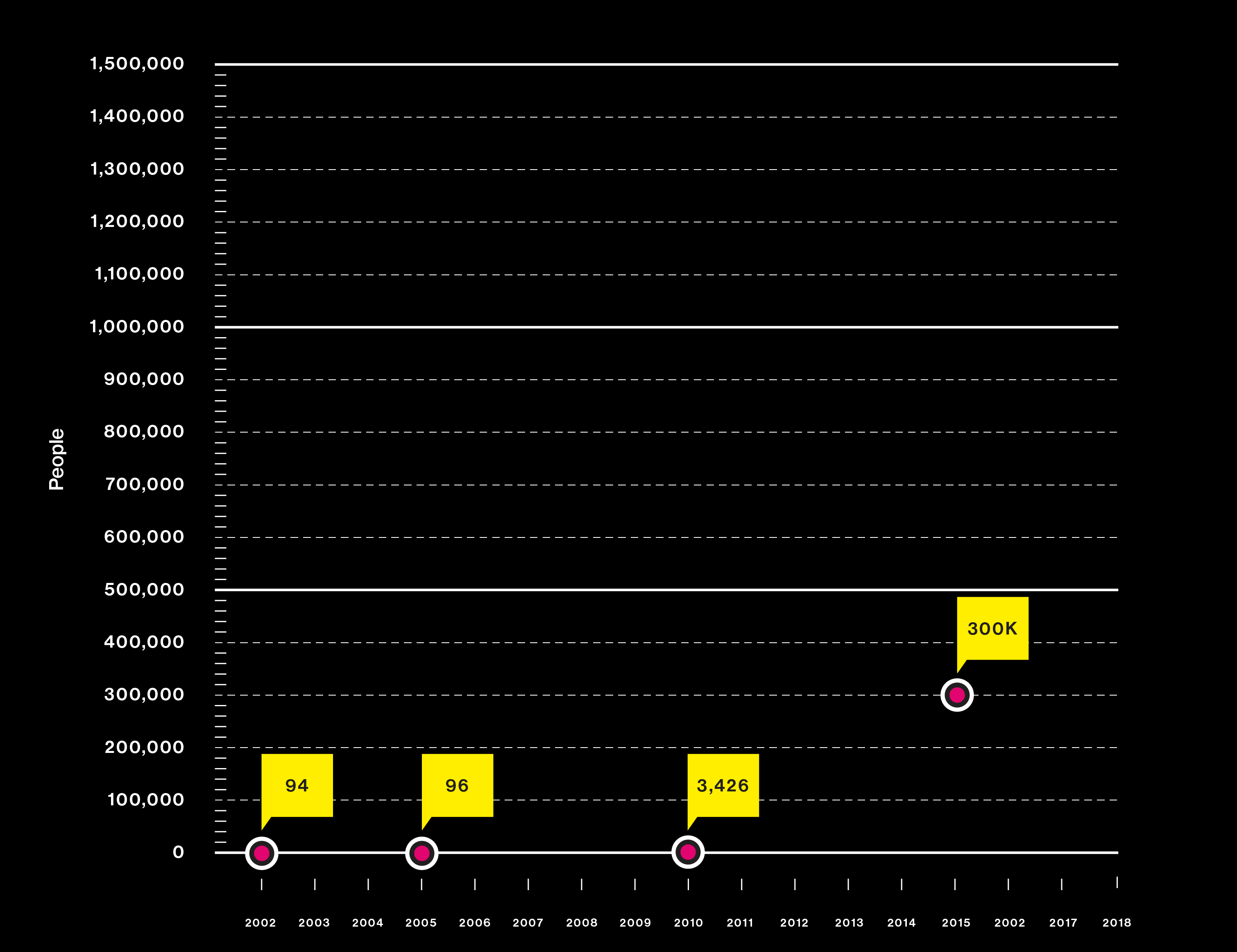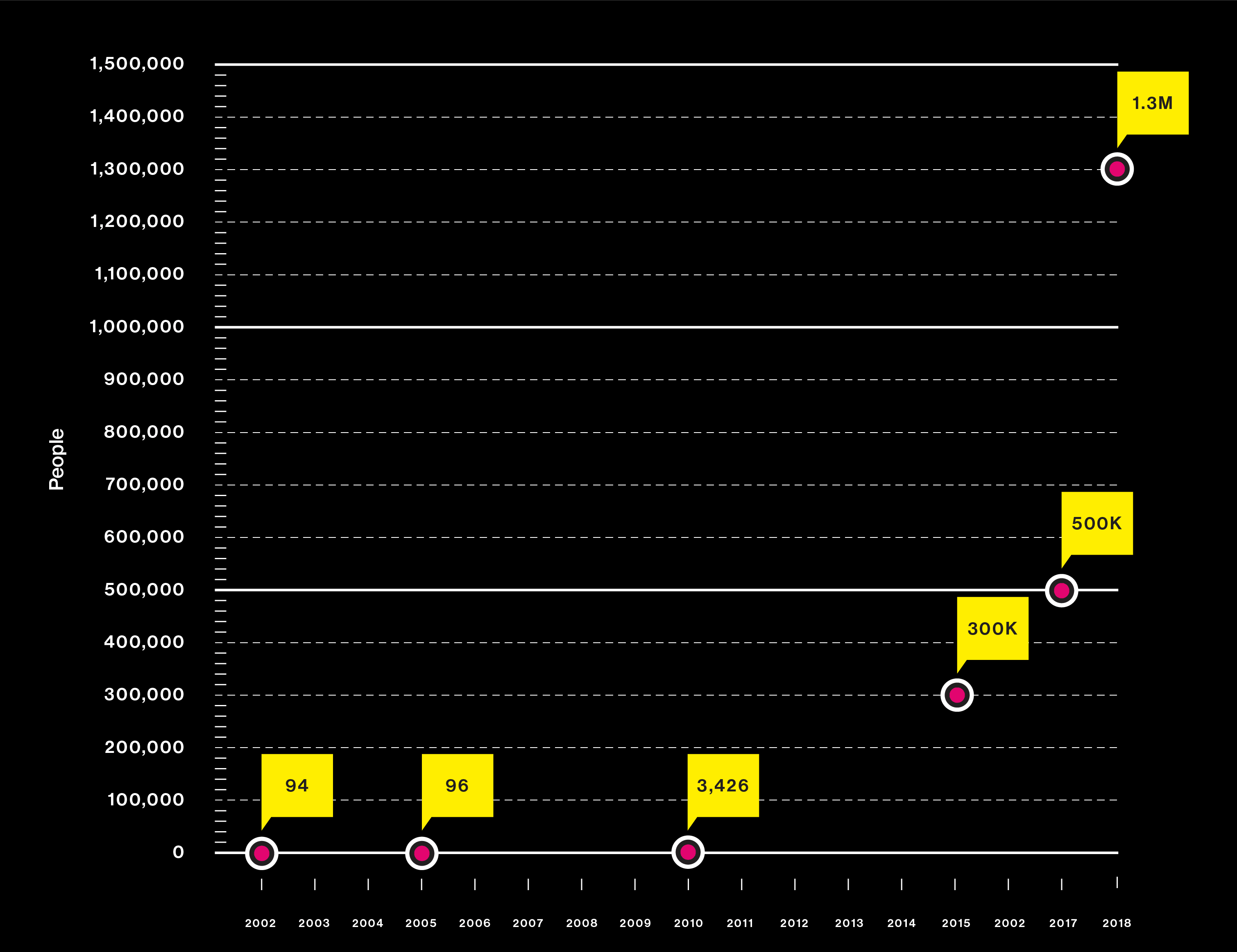
Gráfico: los estudios están usando ADN de más personas que nunca
Algunos avances de la medicina personalizada
2002 Científicos japoneses utilizan un nuevo planteamiento (el estudio de asociación del genoma completo) para buscar las causas del ataque cardíaco.
2005 Una búsqueda de genes revela mutaciones críticas que aumentan el riesgo de la degeneración macular, una causa común de ceguera.
2010 La compañía de pruebas al consumidor 23andMe aporta datos de usuarios a la búsqueda de los genes de Parkinson.
2013 La Administración de Medicamentos y Alimentos de EE.UU. (FDA por sus siglas en inglés) toma medidas enérgicas contra las empresas de pruebas directas al consumidor que ofrecen predicciones de salud genética basadas en el ADN, afirmando que los resultados no eran fiables.
2015 ¿Por qué algunas personas son más gordas que otras? Las claves de un estudio genético se ofrecen rápidamente a los consumidores en forma de test de "dieta del ADN".
2017 Un enorme tesoro de datos genéticos del Biobanco de Reino Unido permite el análisis simultáneo de 2.000 rasgos y enfermedades humanas.
2018 Investigadores identifican los genes vinculados al éxito educativo. Advierten contra el uso de los resultados como un "test de coeficiente intelectual a través del ADN". La búsqueda de los genes para explicar el insomnio es el estudio genético más grande que se haya realizado nunca y depende en gran medida de la base de datos de ADN para el consumidor de 23andMe.
Mukherjee tiene razón en que el ímpetu hacia la medicina de precisión surge de la nueva tecnología. Es sobre lo que puede hacer. Y, de este modo, podemos estar seguros de que aún hay más personalización en el horizonte. Genentech, la empresa que creó Herceptin, ahora está ideando lo que llaman "vacunas contra el cáncer", adaptadas no solo a los amplios subtipos de personas, sino a la firma única del tumor de una persona. El nuevo enfoque implica recopilar información sobre las peculiaridades del cáncer de una persona a través de la secuenciación del genoma a alta velocidad: usar un software para analizar y predecir cómo sería un medicamento biológico personalizado (habrá antígenos, sustancias que estimulan el sistema inmunológico y dan lugar a la formación de anticuerpos) y luego fabricarlo rápidamente.
No existirán dos vacunas iguales. Además, hay que tener en cuenta lo siguiente: si la Administración de Alimentos y Medicamentos de EE. UU. (FDA por sus siglas en inglés) aprueba estas vacunas, no habrá luz verde para un compuesto en particular. En su lugar, se aprobará un proceso informático para convertir la información del ADN en medicamentos.
¿Será la medicina tan programable y predecible como un ordenador? La idea ha comenzado a tener un potente atractivo en Silicon Valley (EE. UU.), donde algunos de los nombres más importantes de la tecnología ahora ven la biología como "solo un código" que pueden descifrar. El inventor del navegador web, Marc Andreessen, es uno de ellos. El fondo de capital que cofundó, Andreessen Horowitz o a16z, ha reservado un total de 650 millones de dólares (573 millones de euros) desde 2015 para invertir en biotecnología. Como afirma con admiración el blog de esta empresa: "no solo puedes lee el código de biología, sino que también puede escribir, o diseñar, con él".
Bienvenido a biotecnología, a16z. Sin duda, se han dado cuenta de algo. Incluso 40 años después del comunicado de prensa sobre la insulina de Genentech, la ingeniería genética es una maravilla que vale la pena redescubrir. La capacidad de ver, comprender y manipular los genes humanos y las proteínas que producen es el gran avance que aún se está desarrollando en toda su inmensa complejidad cuatro décadas después. La biología no está tan bien detallada como un programa de ordenador, pero poco a poco, estamos aprendiendo a controlarla. A las enzimas y anticuerpos les hemos añadido la terapia génica y la edición de genes. No hemos secuenciado un genoma, sino un millón. Un observador astuto podría darse cuenta de que ya hemos recorrido un largo camino.


