
Cuando Sonia Vallabh descubrió el error en su ADN, lo abandonó todo para intentar salvar su vida. Después de años investigando y a punto de doctorarse, ha encontrado un tratamiento prometedor que supone un gran avance en los tratamientos genéticos contra enfermedades hereditarias
En 2011, Sonia Vallabh recibió un informe genético que contenía su sentencia de muerte y, al mismo tiempo, una vía de escape. Vallabh descubrió que su organismo albergaba una mutación genética, una única letra incorrecta en su ADN que le acabaría provocando una enfermedad neurológica llamada insomnio familiar fatal causada por priones. Un año antes de recibir su informe, su madre había fallecido a manos de esa misma enfermedad, y el informe genético descubrió que Vallabh había heredado la mutación.
A día de hoy, la decisión de Vallabh y su esposo, Eric Minikel, de intentar prevenir su enfermedad se ha hecho famosa. The New Yorker publicó una pieza sobre su lucha, titulada Una historia de amor prion. Después de recibir el diagnóstico de esta bomba genética, el matrimonio abandonó sus respectivas carreras en derecho e ingeniería. Su plan consistía en convertirse en científicos dedicados a luchar contra la mutación, y la próxima primavera es probable que ambos obtengan su doctorado (ver Innovadores menores de 35 globales 2016: Sonia Vallabh).
Tras siete años de investigaciones, el matrimonio cree que ha encontrado un tratamiento efectivo. Se trata de un oligonucleótido antisentido, un tipo de molécula de imagen especular que, si llega al cerebro, podría reducir en gran medida la cantidad de proteína priónica. Eso podría prevenir la misteriosa reacción en cadena que provoca el mal plegamiento de las proteínas típico de las enfermedades priónicas. Vallabh explica que la cantidad de proteína priónica disminuye, también lo hacen las posibilidades de desarrollar la enfermedad.
Hace dos semanas, Vallabh publicó en su blog que habían empezado a colaborar con Ionis como socio comercial, una compañía de biotecnología especializada en compuestos antisentido. La publicación decía: "Por primera vez, soy optimista sobre una estrategia terapéutica específica", escribió y añadió que es "probable" que el antisentido pueda tratar la enfermedad "en nuestra vida".
La lucha de Vallabh para prevenir su propia enfermedad priónica plantea una incógnita en torno a la era genética en la que nos estamos adentrando. Si se dispone del mapa perfecto de ADN de una enfermedad hereditaria, ¿cuáles son las probabilidades de detenerlo antes de que cause la muerte?
Parece que las investigaciones médicas como la de Vallabh son más propensas a dar en el clavo. Una de las razones es que la secuenciación genética puede revelar defectos moleculares, pero también se debe a un nuevo conjunto de tecnologías prometedoras (antisentido, terapia génica y edición de genes mediante CRISPR) que son capaces de reemplazar genes o silenciarlos y, en efecto, solucionan problemas genéticos desde su origen.
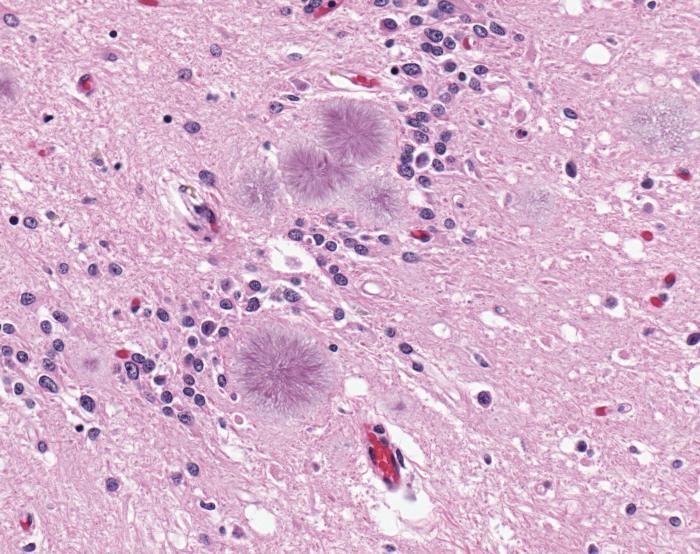
Foto: Primer plano del tejido cerebral afectado por los priones, proteínas mal plegadas tóxicas para las neuronas. Crédito: Wikimedia Commons.
Además, estos tratamientos se crean mediante instrucciones genéticas, es decir, que en realidad están hechos de ADN o ARN. Eso significa que, básicamente, son tratamientos modulares y programables. Así que en teoría, debería ser posible tomar cualquier defecto genético y diseñar rápidamente un antídoto.
Pero la realidad es otra. El desarrollo de medicamentos es muy complejo. La mayoría de los fármacos fallan a causa de sorpresas biológicas y toxicidades inesperadas. Sin embargo, Vallabh afirma que durante los primeros y confusos días de su búsqueda, recibió consejos clave de biólogo director del Instituto Broad, Eric Lander, donde ella y Minikel estudian y trabajan. Lander aseguró que Vallabh debía centrarse en su mutación genética, en el mapa de su informe genético.
Lander le dijo: "Deje de buscar y céntrese en lo que tiene en la mano". Eso significaba no aspirar a responder importantes incógnitas científicas. Vallabh no debía intentar averiguar por qué aparecen los priones ni por qué matan a las células. "Hay muchas preguntas interesantes sobre la enfermedad priónica, pero seguirán sin respuesta cuando ya tengamos el tratamiento", afirma la mujer de 34 años.
Las enfermedades priónicas son increíblemente misteriosas porque no son causadas por un virus, sino por una proteína infecciosa. Entre estas dolencias figuran la tembladera en ovejas, el kuru (que se propaga a través del canibalismo y es similar a la tembladera pero en humanos), la enfermedad de Creutzfelt-Jakob y la versión humana de la enfermedad de las vacas locas.
La idea clave para desarrollar el fármaco es que los ratones modificados genéticamente que carecen del gen de la proteína priónica nunca enfermaran, incluso cuando los científicos inyectan priones infecciosos en sus cerebros. "Un prion es una proteína que cambia su estructura y que puede moldear más copias. Es una autoplantilla, lo que le permite propagarse. Así que la idea consiste en reducir la proteína. Cuanta menos haya, también habrá menos plantillas disponibles", explica el investigador del laboratorio de la Universidad de California en San Francisco (EE. UU.) Kurt Giles, en cuyo laboratorio se descubrieron los priones por primera vez.
Pero las terapias génicas tienen un problema añadido. Todavía no está claro qué proceso hay que seguir para introducirlas en el cuerpo para que ataquen, por ejemplo, a miles de millones de células cerebrales.
La tecnología antisentido, desarrollada hace décadas, vivió un gran avance el año pasado cuando un fármaco desarrollado por Ionis demostró una eficacia sorprendente para tratar un trastorno neurológico infantil, la atrofia muscular espinal (ver El bebé salvado por una terapia de ARN marca una nueva era de fármacos).
Para entonces, Vallabh y Minikel ya habían hablado con Ionis, que había acordado proporcionarles compuestos antisentido dirigidos al gen prion para que hicieran pruebas en ratones. La jefa de neurociencia de Ionis, Holly Kordasiewicz, recuerda la reunión de 2014: "Al salir de la sala sabíamos que teníamos que hacer todo lo posible para ayudarlos". La compañía les dio una lista de cosas para hacer, y la pareja se puso manos a la obra. ¿Registro de pacientes? Listo. ¿Estudios en animales? Listo. ¿Biomarcador para mostrar si un medicamento está funcionando?
Un hospital de Boston (EE. UU.) que estudia los niveles de proteína priónica en el fluido espinal está llevando a cabo una investigación similar. Pero "Sonia y Erik lo están haciendo sin financiación, solo con la esperanza de que suceda", explica el científico-paciente Jeff Carroll, cuyo ADN presenta la mutación responsable de la enfermedad de Huntington, y fue quien les presentó a Ionis.
Un problema más complicado es que la enfermedad priónica es asombrosamente rara, rápidamente mortal y rara vez se diagnostica con antelación. Eso explica por qué no hay mucha gente interesada en los tratamientos. Vallabh cree que solo hay unas 200 personas en EE. UU. conscientes de que albergan la misma mutación. Y actualmente no se ha probado ningún tratamiento contra ella en humanos. Desde el principio, Ionis les transmitió que su colaboración se centraría en resultados académicos, no comerciales.
Un tratamiento antisentido capaz de eliminar la proteína priónica desde su origen podría ser útil contra un abanico de enfermedades raras relacionadas. El insomnio fatal es muy poco frecuente, y lo mismo pasa con la versión humana de las vacas locas, pero cuando los pequeños subgrupos de pacientes se juntan bajo un mismo paraguas, sus dolencias dejan de ser un poco menos raras.
Vallabh y Minikel creen que tienen pruebas de que las moléculas antisentido de Ionis protegen parcialmente a los ratones de la enfermedad priónica. Los animales a los que se les administró el fármaco viven aproximadamente un 70 % más.
Ahora Kordasiewicz cree que la investigación ha dejado el terreno académico y ya está lista para convertirse en un proyecto "comercial" de Ionis. Aunque todavía es un esfuerzo pequeño y está en una fase demasiado inicial como para aparecer en la lista de medicamentos en desarrollo de la compañía. La neurocientífica jefa afirma: "Ahora los datos son lo suficientemente buenos como para pensar que podemos tener un medicamento en cinco años".
Vallabh espera conseguirlo antes. El insomnio fatal podría empezar a afectarle mañana mismo o dentro de 30 años. No hay forma de predecirlo. La pareja acaba de tener su primer hijo, concebida mediante fecundación in vitro. Vallabh afirma que el laboratorio empleó una prueba genética para asegurarles que su hija no portaría la mutación.
Pero para salvarse a sí misma, necesita conseguir un tratamiento eficaz antes de que la enfermedad se manifieste. Sin embargo, los médicos tienen poca experiencia administrando fármacos genéticos durante años como forma de prevención.
El próximo reto del matrimonio es descubrir cómo llevar a cabo tal estudio. Esperan que la Administración de Alimentos y Medicamentos de EE. UU. les permita realizar una prueba preventiva en pacientes con la misma mutación. Dado que pueden pasar décadas hasta que las personas enfermen (o no), dicho estudio se basaría en un biomarcador, por ejemplo, si las inyecciones antisentido reducen los niveles de proteína priónica en el líquido cefalorraquídeo.
Vallabh afirma que se ofrecería voluntaria para probar el fármaco, y concluye: "Estamos avanzando mucho más rápido de lo que nadie se hubiera imaginado gracias a este mapa genético maravillosamente detallado que nos dieron".


