Cuando el científico palestino, Jacob Hanna, especializado en células madre fue retenido al ingresar a EE UU el pasado mayo, los agentes de aduanas lo apartaron y lo mantuvieron durante horas en «secundaria», una oficina trasera donde no se tiene acceso al pasaporte ni al teléfono móvil. En la sala había dos jóvenes rusas y una máquina expendedora de caramelos. Hanna, que lleva barba recortada, gafas y un pasaporte israelí, aceptó el escrutinio. «Es casi como estar arrestado, pero de forma amistosa», comenta. Accedió a entregar su teléfono y sus redes sociales para ser inspeccionadas.
«Me dijeron: «Tiene derecho a negarse»», recuerda, «y respondí: «No, no, soy un libro abierto»». Al revisar sus perfiles, los agentes descubrieron que Hanna forma parte de la pequeña minoría árabe cristiana de Israel, es defensor de los derechos LGBTQ no binarios y crítico abierto de la ocupación de Gaza. En sus redes sociales publica imágenes de atrocidades y lanza mensajes dirigidos a sus colegas científicos, incluidos los del Instituto Científico de Weizmann, el centro de investigación básica donde él trabaja, como la versión israelí del Instituto Tecnológico de California (Pasadena, EE UU) o de la Universidad Rockefeller (Nueva York, EE UU). En su equipaje, encontraron su keffiyeh, el pañuelo tradicional que Hanna prometió usar en sus conferencias internacionales.
No era la primera vez que lo detenían, conocía el procedimiento: «¿Algo que declarar? ¿Alguna muestra biológica?» Esta vez las preguntas de los agentes tocaron un nuevo tema muy específico: los embriones.
Semanas antes, una investigadora de la Universidad de Harvard (Cambridge, EE UU) había sido arrestada por llevar embriones de rana en su equipaje y enviada a un centro de detención en Luisiana. Hanna no llevaba muestras de su laboratorio, pero si las hubiera tenido, habría sido difícil explicar qué eran. Su equipo se especializa en modelos sintéticos de embriones: estructuras que imitan a los embriones reales, pero sin esperma, óvulos ni fertilización.
En lugar de seguir la receta biológica tradicional, Hanna induce el desarrollo de cuerpos animales directamente a partir de células madre. Si se combinan correctamente, estas células intentan organizarse espontáneamente en un embrión, una hazaña que permite estudiar las primeras fases del desarrollo y podría abrir la puerta a nuevas fuentes de tejidos para medicina de trasplantes.
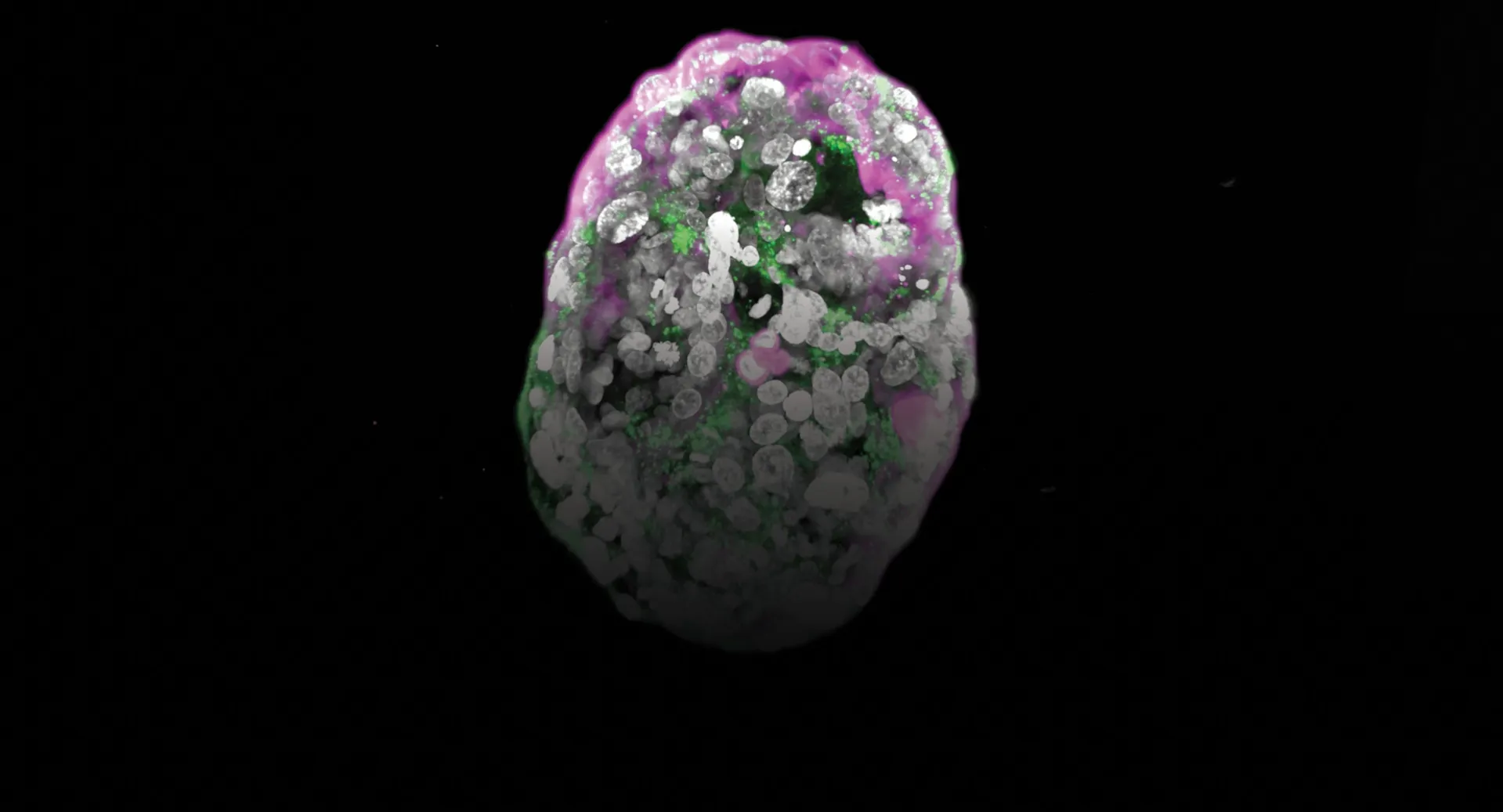
En 2022, trabajando con ratones, Hanna logró crear embriones sintéticos con corazones aún latientes y pliegues neurales, cultivados en frascos conectados a un mezclador de gases, una especie de útero artificial. Al año siguiente, repitió el experimento con células humanas. Aunque las estructuras estaban menos desarrolladas y aún esféricas, imitaban sorprendentemente bien a un embrión humano de dos semanas, incluyendo células destinadas a formar la placenta.
Estos modelos aún no son embriones en sentido estricto. Rara vez se forman correctamente, ya que se necesita un centenar de intentos para lograr uno, y omiten pasos antes normales antes de salir a la luz. Sin embargo, para científicos como el biólogo francés Denis Duboule, las creaciones de Hanna son «totalmente asombrosas y muy inquietantes». Duboule prevé que pronto será difícil distinguir entre un embrión humano real, con protección legal, y uno generado a partir de células madre.
Hanna está a la vanguardia de un movimiento que combina técnicas avanzadas de genética, biología de células madre y úteros artificiales aún rudimentarios para crear cuerpos fuera del útero. En esta carrera participan investigadores del Instituto Tecnológico de California (Pasadena, EE UU), la Universidad de Cambridge (Cambridge, Reino Unido) y la Universidad Rockefeller (Nueva York, EE UU), además de un número creciente de start-ups con fines comerciales. Entre ellas, está Renewal Bio, una start-up cofundada por Hanna, que aspira a cultivar embriones sintéticos como fuente para células jóvenes de reemplazo, como fragmentos de hígado o incluso óvulos. En Europa, Dawn Bio ha comenzado a colocar un tipo de modelo embrionario llamado blastoid sobre tejido uterino. Esto activa un test de embarazo y, según la compañía, podría ofrecer nuevas perspectivas para la medicina de fecundación in vitro. Las oficinas de patentes en EE UU y Europa están recibiendo una avalancha de solicitudes, mientras las universidades intentan asegurarse el control comercial exclusivo sobre estos nuevos tipos de seres.
Hanna rechazó hablar sobre su investigación para este reportaje. Sin embargo, durante los últimos tres años, MIT Technology Review ha seguido su trayectoria en presentaciones virtuales, conferencias y dos encuentros presenciales sobre ética, organizados por el Observatorio Global para la Mutación del Genoma, un proyecto de consulta pública en el que Hanna aceptó dialogar con teólogos, bioeticistas y otros expertos. El resultado es el retrato de un científico que trabaja a nivel de Premio Nobel, pero cuya investigación, aunque aprobada por su institución, plantea serias preguntas éticas a largo plazo.
Hasta dónde ha llegado Hanna con sus modelos de embriones humanos es una incógnita. Según declaraciones públicas de Renewal Bio, la respuesta es que ha llegado al menos hasta el día 28 de desarrollo. Pero podría ser más. Un científico en contacto con la empresa cree que han alcanzado casi el día 40, cuando comienzan a formarse los ojos y los primeros brotes de extremidades. Renewal no respondió a la solicitud de comentarios.
Aunque aún no haya llegado tan lejos, Hanna tiene la intención de hacerlo. Su equipo está «intentando crear entidades en etapas más avanzadas, que, según el objetivo, podría ser el día 30, el día 40 o el día 70 de desarrollo», dijo en mayo pasado en Cambridge, Massachusetts, durante un panel del Observatorio Global con teólogos y científicos sociales. Las versiones más avanzadas serían similares en tamaño y desarrollo a un feto de tres meses.
Carter Snead, bioeticista de la Universidad de Notre Dame (Notre Dame, EE UU) que moderó el panel, se acercó después para preguntar si había escuchado lo que Hanna había dicho. Snead se sorprendió por la franqueza del científico y por el hecho de que nadie objetara, o tal vez ni siquiera comprendiera lo que implicaba. Quizá, piensa Snead, esta tecnología no se asimile hasta que la gente pueda verla con sus propios ojos. «Si tuvieras uno de esos frascos giratorios con algo que pareciera un feto humano dentro, creo que captarías la atención de la gente», afirma. «Sería como: ¿qué estamos haciendo?».
Snead, católico y miembro de un panel asesor del Vaticano, tampoco se sintió tranquilo con el plan de Hanna para garantizar que sus modelos, si avanzan a etapas posteriores, superen el escrutinio ético. Ese plan consiste en bloquear la formación de la cabeza, el cerebro o incluso el corazón de las estructuras sintéticas, mediante modificaciones genéticas. Este es el razonamiento de Hanna: si no hay cerebro, no hay conciencia, no hay persona, y por tanto, no hay ninguna transgresión, solo un conjunto de órganos.
Snead sostiene que ese no es el mismo estándar de humanidad que él conoce, que trata a todos los seres humanos por igual, independientemente de su capacidad intelectual o cualquier otra característica. «¿Qué se considera humano? ¿Quién se considera humano?», se pregunta Snead. «Es quién está dentro y quién está fuera. Hay una consecuencia dramática entre estar dentro o fuera de los límites de la humanidad».
El origen de los cuerpos
Todos nosotros, el lector, yo e incluso Jacob Hanna, surgió de un óvulo fecundado, una única célula capaz de dividirse y ejecutar dinámicamente un programa que construye un cuerpo completo, con todos sus órganos y miles de millones de células especializadas. La ciencia lleva décadas intentando aprovechar ese potencial extraordinario. Un primer avance llegó en los años noventa, cuando los investigadores lograron aislar células madre de embriones de cinco días creados mediante fecundación in vitro y mantenerlas vivas en laboratorio. Estas células madre embrionarias tienen la capacidad inherente de convertirse en cualquier otro tipo celular. Si se lograra guiarlas para formar, por ejemplo, neuronas o células productoras de insulina, se abriría una vía para tratar enfermedades mediante trasplantes celulares.
Pero las recetas de laboratorio suelen fallar, lo que explica la escasez de tratamientos nuevos con células madre. «La triste realidad es que, tras más de 25 años trabajando en este problema, hay unas diez tipologías celulares que se logran con una funcionalidad razonable», afirma Chad Cowan, director científico de la empresa Century Therapeutics. Si pensamos en el cuerpo como un coche, explica, «solo tenemos bujías. Quizá algunas ruedas». Las células más potentes para formar sangre, en particular, «nunca aparecen», según Cowan, pese a que las biotech han invertido millones en intentar generarlas.
Sin embargo, las células madre conservan un impulso natural por colaborar. Los científicos empezaron a notar que, cuando se las dejaba solas, tendían a agruparse en masas, tubos y cavidades, algunas de las cuales recordaban partes de un embrión.
Las primeras versiones de estas estructuras eran rudimentarias, apenas una película de células girando sobre un portaobjetos. Pero cada año se vuelven más realistas. En 2023, Hanna describía lo que llamó un modelo bona fide, un modelo de embrión humano «totalmente integrado», con todas las partes principales dispuestas en una arquitectura difícil de distinguir de la real.
Su empresa, Renewal, planea usar estos embriones sintéticos como una especie de «impresora biológica«, capaz de producir células médicamente valiosas en casos donde otros métodos han fracasado. Esto podría ser especialmente útil si los embriones sintéticos coinciden perfectamente con el ADN del paciente. Y eso también es posible: hoy en día, reprogramar células de la piel en células madre es una tarea sencilla. Hanna lo ha probado consigo mismo, transformando sus propias células en embriones sintéticos.
La investigación de Hanna, y la de otros grupos, ha chocado en ocasiones con la Sociedad Internacional para la Investigación de Células Madre (ISSCR, por sus siglas en inglés), un organismo de autorregulación científica que establece los límites sobre qué investigaciones pueden publicarse y qué terminología debe emplearse. Su objetivo es proteger a los científicos de titulares sensacionalistas, reacciones públicas adversas o la intervención de reguladores oficiales.
La organización ha adoptado una postura categórica respecto a las estructuras creadas a partir de células madre, calificándolas simplemente como «modelos». En un comunicado emitido en 2023, afirmó que «los modelos embrionarios no son sintéticos ni embriones» y añadió que «no pueden ni podrán desarrollarse hasta una etapa postnatal humana».
Muchos científicos, incluido Hanna, coinciden en que nadie debería intentar crear un bebé a partir de células madre. Pero él está convencido de que estas estructuras serán cada vez más realistas y podrán desarrollarse más. De hecho, ese podría ser el verdadero criterio para definir qué es un embrión: si puede avanzar dinámicamente hacia nuevas etapas de desarrollo, especialmente la organogénesis, o aparición de los órganos. El lenguaje del comunicado de la ISSCR, se quejó Hanna, era una forma de «lavado de cerebro».
Piezas de repuesto
La mayoría de los proyectos comerciales con embriones sintéticos están condenados a una vida breve e irregular, porque la tecnología aún es demasiado compleja o inmadura. Pero la idea no desaparece. Al contrario, hay señales de que está creciendo y volviéndose aún más extraña. En un editorial publicado en marzo por MIT Technology Review, un grupo de científicos de Stanford propuso el concepto de bodyoids, argumentando que las células madre y los úteros artificiales podrían generar una «fuente ilimitada» de cuerpos humanos sin conciencia, útiles para investigación farmacológica o como donantes de órganos. Uno de los autores, Henry Greely, un bioeticistas muy reconocido de EE UU, publicó en Bluesky que, aunque la idea le produce «escalofríos», decidió firmar porque considera que es lo suficientemente plausible como para requerir debate, y «que sea pronto».
Especialmente en el Área de la Bahía de San Francisco, los cuerpos sin cabeza están en tendencia. El biólogo de Stanford (California, EE UU) Hiro Nakauchi, otro autor del editorial sobre bodyoids, afirma que el artículo le abrió inesperadamente las puertas a un mundo de start-ups que ya trabajan en embriones sintéticos, úteros artificiales y «repuestos» corporales. Conoció al CEO de la empresa de Hanna y se unió como asesor. Pero hay otros colectivos que tienen planes aún más radicales. Un inversor en capital de riesgo lo presentó a un emprendedor del sector longevidad que está desarrollando un proyecto de trasplante de cabeza. La idea: intercambiar tu cabeza envejecida por el cuerpo de un clon joven. Esa empresa asegura tener oficinas en una isla del Caribe «igual que Jurassic Park«, según Nakauchi.
Este tipo de planes, ya sean reales o rumores, han captado la atención de los «policías de las células madre«, la ISSCR. En junio, un comité ético liderado por Amander Clark, especialista fetal en UCLA (Los Ángeles, EE UU) y expresidenta de la sociedad, escribió que había detectado «grupos comerciales que plantean la posibilidad de construir un embrión in vitro» y llevarlo a viabilidad dentro de «sistemas artificiales». Aunque la ISSCR había decretado previamente que los modelos embrionarios «no pueden ni podrán» desarrollarse hasta término, ahora declaró que los intentos de alcanzar viabilidad son «inseguros y poco éticos», y los incluyó en la categoría de «prohibidos». Añadió que la prohibición se aplicaría «a cualquier propósito: reproductivo, comercial o de investigación».
Fronteras difusas
Clark y sus colegas tienen razón al afirmar que, por ahora, nadie va a sacar un bebé a término de un frasco. Eso sigue siendo ciencia ficción. Pero hay un asunto urgente que debe abordarse ya: qué hacer con los modelos de embriones sintéticos que se desarrollan solo parcialmente durante semanas o meses, como propone Hanna.
Porque hoy en día, casi ninguna ley o política se aplica a los embriones sintéticos. Una razón es su origen no natural: al no comenzar con la concepción y crecer en laboratorio, la mayoría de las leyes existentes no los contempla. Eso incluye la Ley de Prohibición de Crianza de Fetos, aprobada por unanimidad en 2006 por el Congreso de EE UU, que buscaba evitar que alguien cultivara un feto para extraerle órganos. Pero esa ley menciona «un embarazo humano» y un «útero», y no habría ninguno si el embrión sintético se desarrollara en un recipiente mecánico.
Otra norma bajo presión es la «regla de los 14 días«, una convención ampliamente utilizada que establece que los embriones naturales no deben cultivarse más de dos semanas en laboratorio. Aunque es un límite algo arbitrario, ha sido útil para que los científicos sepan hasta dónde pueden llegar. Pero esa regla no se aplica a los modelos embrionarios. Por ejemplo, aunque el Reino Unido tiene una ley que consagra la regla de los 14 días, esa legislación no define qué es un embrión. Para los científicos que trabajan con modelos, eso representa una laguna crítica. Si las estructuras no se consideran embriones reales, entonces la norma no aplica.
El año pasado, la Universidad de Cambridge (Cambridge, Reino Unido) describió la situación como una «zona gris» y afirmó que «ha dejado a científicos y organizaciones de investigación en la incertidumbre sobre los límites aceptables de su trabajo, tanto legales como éticos».
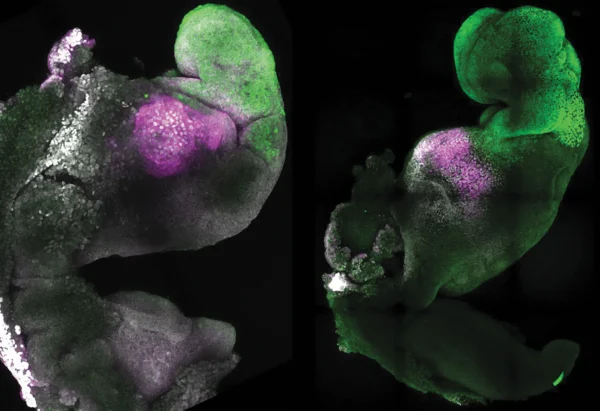
Investigadores de esa universidad, que es un centro destacado en modelos de embriones humanos, han trabajado con uno que presenta características avanzadas, incluidas células cardíacas latientes. Pero la aparición de rasgos distintivos bajo el microscopio resulta inquietante incluso para los propios científicos. «Me asusté, sinceramente», declaró Jitesh Neupane, líder del proyecto, al Guardian en 2023. «Tuve que mirar hacia abajo y volver a mirar».
Ese modelo concreto de células madre no está completo: carece por completo de células placentarias y de cerebro. Por tanto, no es un embrión real. Pero cada vez será más difícil insistir en que estos modelos no cuentan, dada la acelerada carrera por hacerlos más realistas. Para Denis Duboule, los científicos están atrapados en la llamada «paradoja del ingenuo» y en una «situación bastante inestable».
Incluso los modelos incompletos plantean la cuestión de dónde trazar la línea. ¿Debería detenerse el desarrollo cuando puede sentir dolor? ¿Cuando su aspecto humano resulta incómodamente familiar? Los líderes científicos pronto podrían tener que decidir si existen rasgos humanos «moralmente significativos», como las manos o el rostro, que deberían evitarse, independientemente de si la estructura tiene cerebro o no. «Personalmente creo que debería haber regulación, y muchos en el campo también lo creen», afirma Alejandro De Los Ángeles, biólogo de células madre vinculado a la Universidad de Florida Central (Orlando, EE UU).
Hanna asegura contar con todas las aprobaciones necesarias en Israel para continuar con su trabajo. Pero también teme que las reglas puedan cambiar. «Soy casi el único [en Israel] que realiza este tipo de experimentos, y siempre vivo con el miedo de verme envuelto en algún tipo de escándalo», dice. «Las cosas pueden cambiar muy rápido por razones políticas».
Sus declaraciones sobre la situación en Gaza lo han convertido en blanco de ataques. Ha recibido mensajes de voz cuestionando por qué un profesor del Instituto Weizmann muestra simpatía por Palestina, y una vez, al regresar de un viaje, se encontró que alguien había colocado una boina del ejército israelí en la manilla de su coche. El año pasado, asegura, sus opositores políticos incluso atacaron su ciencia presentando una denuncia alegando que su investigación era ilegal.
Lo que sí está claro es que Hanna, sociable y atento, ha trabajado para construir una red amplia de amistades y aliados, incluidos líderes religiosos, como parte de una campaña para explicar la ciencia y escuchar otras perspectivas. Dice haber obtenido la nota perfecta en una clase de bioética con un rabino, haber conversado con un sacerdote de su ciudad natal en Galilea e incluso haber rendido homenaje a un profesor ortodoxo en un hospital conservador de Jerusalén. «Fue algo informal. No necesitaba su permiso», comenta Hanna. «Pero… ¿qué opina? ¿Puedo contar con él? ¿Obtengo una visión distinta?».
«De verdad creo que es admirable que esté dispuesto a hacerse estas preguntas difíciles sobre lo que está haciendo. Eso lo diferencia», afirma Snead. «Pero si uno es cínico, podría preguntarse si su enfoque ético no es más bien una estrategia de marca«. Tal vez, añade Snead, sea una forma de presentar estas estructuras como la «alternativa verde y sostenible a los embriones».
Un latido en un frasco
Para sus admiradores, Hanna es un médico e investigador «muy por encima del resto», según Eli Adashi, exdecano de la facultad de medicina de la Universidad de Brown (Providence, EE UU). «Es muy inusual, muy especial, y está haciendo descubrimientos importantes que no pueden ignorarse», afirma Adashi. «Es una de esas personas excepcionalmente talentosas que superan la capacidad de los mortales, y además, viene de un pueblo de Galilea que nadie sabe que existe».
Aunque es poco común que un palestino alcance tal nivel en la élite científica israelí, Hanna proviene de una familia de médicos, y su tío, Nabil Hanna, co-desarrolló el primer fármaco de anticuerpos contra el cáncer, el exitoso rituximab.
Desde el ataque del 7 de octubre de Hamás contra Israel, el país está en guerra en Gaza, y el equipo de Hanna ha sentido las consecuencias. Un joven científico dejó la pipeta para ponerse el uniforme del ejército israelí. Otro aprendiz, originario de Gaza, perdió a su hermano y a otros familiares por un misil israelí que impactó cerca de una iglesia donde se refugiaban. En junio, un misil balístico iraní alcanzó el campus del Instituto Weizmann, rompiendo ventanas y muros, y obligando a los estudiantes de Hanna a apresurarse para salvar su investigación.
A pesar de los retrasos provocados por el conflicto, las ideas y tecnologías de Hanna se están exportando y replicando. Un lugar donde puede verse una versión del útero artificial es el Campus de Investigación de Janelia, en Virginia (EE UU), donde uno de sus antiguos alumnos, Alejandro Aguilera Castrejón, dirige su propio laboratorio. Aguilera Castrejón, para quien la ciencia fue un billete de escape de los barrios pobres de Ciudad de México, lleva tatuajes desde las muñecas hasta los codos el más reciente representa una hidra, un pólipo marino conocido por regenerarse a partir de unas pocas células.
Durante una visita en junio, Aguilera Castrejón retiró una cubierta negra para mostrar el incubador: una rueda metálica que giraba lentamente, agitando suavemente frascos llenos de suero sanguíneo. Dentro de uno, flotaba un embrión de ratón con una forma diminuta y translúcida, curvada como una coma. Y entonces, de forma asombrosa, una masa rojiza se expandió en su centro. Un latido.
Ese día, el frasco contenía un embrión de ratón normal, transferido allí para observar hasta dónde podía crecer. Aguilera Castrejón tiene como objetivo lograr el nacimiento de un ratón desde un incubador por un proceso llamado ectogénesis. Pero los embriones creados a partir de células madre no crecen tan bien ni por tanto tiempo, explica. El problema no es solo el cultivo en frascos. Probablemente haya algún tipo de desorganización fundamental. No son del todo normales, todavía no son verdaderos embriones.

Aguilera Castrejón, que pasó ocho años en el Instituto Weizmann contribuyendo a la investigación de Hanna, es escéptico respecto a que la versión humana de esta tecnología esté lista para su comercialización. Por un lado, es ineficiente. De cada 100 intentos de crear un embrión sintético, solo uno o dos logran la estructura deseada. El resto son masas desorganizadas, más parecidas a huevos fritos que a embriones reales, dice. «Creo que el modelo de embrión humano avanzará más, pero podría tardar años», añade.
En su opinión, Hanna está bien posicionado para liderar ese trabajo y la razón es que Israel y el pensamiento judío, ambos ofrecen un entorno bastante permisivo. En el Talmud, el embrión se considera «agua pura» hasta el día 40. Además, Hanna ya ha tenido éxito. «Algunas personas no tienen permiso para hacerlo. Y otras quieren hacerlo, pero no pueden», dice Aguilera Castrejón. «Jacob quiere hacerlo lo más realista posible y llegar lo más lejos posible, ese es su objetivo. Es muy ambicioso y quiere abordar cosas muy grandes que otros no se atreven a hacer. Su objetivo principal siempre es hacerlos crecer tanto como sea posible».
El primer beneficio de esta tecnología para imitar embriones es ofrecer una nueva visión del desarrollo humano que nunca antes se había tenido. Los embriones humanos reales rara vez se observan en sus primeras etapas, ya que están dentro del útero, y a las cuatro o cinco semanas, muchas personas ni siquiera saben que están embarazadas. Ha sido siempre una caja negra. Pero los modelos sintéticos pueden producirse por miles (según el tipo), estudiarse de cerca, inspeccionarse con microscopios modernos y someterse a tintes y herramientas de ingeniería genética, todo mientras siguen vivos. Si se añade una sustancia tóxica conocida por causar malformaciones, como la talidomida, se pueden rastrear sus efectos con precisión. «Como no tenemos forma de mirar dentro del útero, esto nos permite observar como si fuera intrauterino, pero no lo es», explica Adashi, exdecano de Brown y médico especialista en fertilidad.
Además, un embrión sintético podría generar células correctamente, de la misma manera que lo haría uno real, y producirlas de todos los tipos a la vez, superando las pocas que los científicos logran crear hoy a partir de células madre. Aunque no todo el material embrionario es útil para la medicina, se sabe que las células formadoras de sangre en un embrión son especialmente potentes. En ratones, pueden extraerse y multiplicarse, y si se trasplantan a un ratón sometido a radiación letal, lo salvan.
Hanna imagina un paciente con cáncer que necesita un trasplante de médula ósea pero no encuentra un donante compatible. ¿Podrían extraerse células formadoras de sangre de, digamos, 100 o 500 clones embrionarios de esa persona, proporcionando tejido perfectamente compatible?
En su análisis de coste-beneficio, Hanna cree que la posibilidad de salvar vidas supera el riesgo moral de cultivar modelos embrionarios durante un mes, que es aproximadamente el tiempo necesario para que se formen las células sanguíneas clave. En esa etapa, afirma, «aún no hay personificación del embrión», y considera legítimo usarlos en investigación.
Todo es joven
Hanna cofundó Renewal en 2022 junto a Omri Amirav-Drory, inversor en capital riesgo cuyo fondo, NFX, recaudó unos 9 millones de dólares para la empresa y adquirió derechos sobre patentes del Instituto Weizmann. La idea de la start-up es crear embriones sintéticos a partir de células de pacientes, permitiendo que crezcan durante semanas o meses para producir lo que Amirav-Drory llama «células perfectas» para trasplantes. Esto se debe a que la estructura sintética, al ser un clon, mantendría «todos los órganos jóvenes y genéticamente idénticos».
Durante un evento para futuristas tecnológicos celebrado el año pasado cerca de San Francisco, Amirav-Drory mostró una imagen de unas pruebas de embarazo realizadas sobre embriones sintéticos. «Incluso fuimos a CVS [una cadena farmacéutica muy conocida en EE UU]», dijo, «y para el día ocho ya daba positivo una prueba de embarazo. Por lo que estaba vivo».
Amirav-Drory es fan de Peter F. Hamilton, autor de ciencia ficción cuya serie, Commonwealth, presenta una sociedad donde los colonos espaciales transfieren sus mentes a cuerpos clonados, obteniendo una segunda vida. Y ha presentado la tecnología de Hanna en términos similares, como una nueva medicina de longevidad basada en reemplazar células viejas por jóvenes. Está convencido de que el trabajo de Hanna es tan «mágico» que merece un Premio Nobel. Pero sabe que la start-up enfrenta desafíos técnicos y éticos.
El reto técnico es que, una vez que los embriones sintéticos alcanzan cierto tamaño y edad, el incubador ya no puede mantenerlos. Esto se debe a que carecen de sistema circulatorio y necesitan absorber oxígeno y nutrientes del entorno: se mueren de hambre al crecer demasiado. Una solución que se está considerando es añadir una sonda de alimentación, pero eso implica microcirugía y no es fácilmente escalable.
El dilema ético también está relacionado con la edad: cuanto más se desarrollan, más reconociblemente humanos se vuelven, con órganos incipientes y dedos y pies pequeños con membranas. «Nadie tiene problema con el día 14, pero cuanto más avanzamos, más se parece a un bebé, y ahí empiezan los problemas. ¿Cómo lo resolvemos?», preguntó Amirav-Drory en otro evento en Menlo Park.
La solución, por ahora, es la inactividad neuronal: modificaciones genéticas aplicadas a los embriones para que no desarrollen cerebro. El grupo ya ha probado el concepto en ratones, eliminando un gen llamado LIM-1. El resultado fue un ratón sin cabeza, que parece un pulgar rosado, aunque con pequeñas garras y cola. Esos ratones no sobreviven tras el nacimiento, pero pueden desarrollarse en el útero. «Logramos que embriones sintéticos de ratón crecieran sin cabeza, sin cerebro», dijo Amirav-Drory en Menlo Park. «Solo para mostrar hasta dónde podemos llegar para resolver problemas técnicos y éticos».
La idea de eliminar el cerebro está sorprendentemente activa en la investigación, lo que sugiere que no es un experimento marginal. En Stanford, el equipo de Nakauchi está probando varias modificaciones genéticas para ver si pueden generar de forma consistente un animal sin cabeza ni cerebro, pero con tejidos normales. «La importancia de eliminar la cabeza es totalmente ética. Significa que podemos crear todos estos cuerpos y estructuras orgánicas sin cruzar líneas éticas ni dañar seres conscientes», afirma Carsten Charlesworth, investigador en el laboratorio de Nakauchi. El grupo trabaja en un «paquete de software genético» que pueda añadirse a embriones de ratón para crear un «fenotipo reproducible».
Puede parecer contradictorio que una técnica diseñada para generar vida a partir de células madre se combine con una táctica para reducir esa vida. Para Douglas Kysar, profesor de derecho en la Escuela de Derecho de Yale (New Haven, EE UU), esto forma parte de una tendencia más amplia hacia lo que llama «vida que no es vida», que incluye innovaciones como la carne cultivada en laboratorio. En el ámbito del derecho animal, Kysar estudia proyectos biotech comerciales que exploran lo que denomina desmejora y deingenierización: el uso de la genética para reducir la capacidad de los animales de sufrir, sentir dolor o tener experiencia consciente, generalmente como parte de programas para mejorar la eficiencia y la ética en la producción alimentaria.
En humanos, por supuesto, la preocupación sobre la ingeniería genética suele centrarse en la mejora: crear bebés con ventajas. Es mucho más difícil encontrar ejemplos donde se apliquen desmejoras al embrión humano. John Evans, codirector del Insituto de Ética aplicada en la Universidad de California (San Diego, EE UU), dice que solo se le ocurre uno, en la literatura. Los planes de Hanna le recuerdan al Proceso Bokanovsky, el método ficticio para producir clones con distintos niveles de inteligencia en la novela Brave New World, publicada en 1932.
Eso no parece espantar a los inversores. Últimamente, los argumentos de las distopías de ciencia ficción como Jurassic Park o Gattaca, parecen estar siendo reciclados por las biotech más prometedoras. Está Colossal, la empresa que quiere recrear animales extintos. Aguilera Castrejón afirma haber recibido ya una oferta millonaria para abandonar su laboratorio académico y unirse a una start-up que quiere construir un útero artificial. Y cuando Hanna asistió al encuentro del Observatorio Global cerca de Boston a principios de este año, lo seguía de cerca Matt Krisiloff, CEO de Conception, una empresa de Silicon Valley creada para fabricar óvulos humanos en laboratorio, con financiación de Sam Altman, líder de OpenAI.
Los óvulos son otro tipo celular que ha resultado difícil de generar a partir de células madre en laboratorio. Pero un feto en desarrollo formará millones de óvulos inmaduros. Así que imagina: alguien demasiado mayor para concebir dona sangre, que se convierte en células madre y luego en un clon, del cual se extrae la gónada fetal. Tal vez las células reproductivas encontradas allí puedan madurar en laboratorio. O quizá esos ovarios jóvenes, perfectamente compatibles (porque son sus ovarios, en realidad, y no los de otra persona) puedan reimplantarse en su cuerpo para terminar de desarrollarse. Un experto en fertilidad, David Albertini, afirma que podría ser posible.
Durante una reunión ética para la que viajó a EE UU en mayo, Hanna participó en un panel cuyo tema era «fuentes de autoridad moral». Su autoridad proviene de los posibles beneficios que la ciencia de los embriones sintéticos podría aportar. Pero también ejerce una credibilidad moral. Al inicio de su intervención, Hanna planteó el asunto de forma que preocuparse por lo que se estaba gestando empezaba a parecer trivial. Con una keffiyeh sobre los hombros, dijo: «Me gustaría comenzar y, bueno, recordarles a todos, lamentablemente, que ahora mismo hay un genocidio en curso en Gaza, donde se está matando de hambre a niños de forma intencionada. Y esto es relevante, porque estamos aquí hablando de la dignidad humana, del estatus de un embrión, y del estatus de un feto. Pero ¿qué pasa con la vida de los niños, de los adultos, de los inocentes? ¿Cómo se relaciona todo esto?».







