
Varios pacientes de leucemia ya se han curado mediante una técnica que modifica genéticamente las células-T en la que Novartis ya ha mostrado su interés

Cuando Milton Wright III recibió el tercer diagnóstico de cáncer, lloró hasta reírse. Tenía veinte años, y ya había sobrevivido dos veces a la leucemia, primero a los ocho años y después siendo adolescente. Cada vez, sufrió años de quimioterapia castigadora.
Pero esta vez había ingresado en el Hospital Infantil de Seattle (EEUU). Aspirante a modelo, se había caído antes de una sesión de fotos y el dolor que sentía en el costado no remitió. Cuando los médicos empezaron a prepararle para una punción lumbar, supo que el cáncer había vuelto. "Me dije: 'Vaya, me van a decir que he recaído otra vez'", recuerda. "Me van a dar seis meses".
Sabía que a la tercera vez no va la vencida; había visto a suficientes niños enfermos en la Casa de Ronald McDonald (una fundación benéfica dedicada al bienestar infantil) como para saber que cuando resurge el cáncer de esta manera, normalmente se ha vuelto resistente a la quimioterapia. Casi nadie la sobrevive.
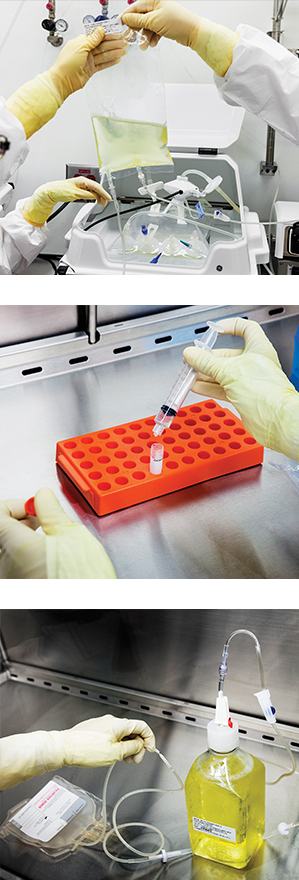
Arriba: Una bolsa biorreactiva contiene las células-T de un paciente de leucemia. Las células se han modificado genéticamente para añadir un nuevo receptor para combatir el cáncer.
Centro: Una muestra de las células-T se prepara para pasar el control de calidad. Estas instalaciones están en Manhattan, en el Hospital Memorial Sloan Kettering.
Abajo: Una botella de nutrientes se emplea para alimentar las células-T, que se cultivan durante unos 10 días, hasta que se cuenten por miles de millones. Entonces se pueden reinfundir por las venas del paciente.
Pero Wright sí sobrivivió. En 2013 su cáncer, una leucemia linfoblástica aguda, fue destruido por un tratamiento nuevo que consta de la extracción de células del sistema inmunológico llamadas linfocitos T, o células-T, para la posterior modificación genética de estas células para que ataquen al cáncer, y la reintroducción de las células al paciente por vía intravenosa.
Aunque Wright solo fue la segunda persona del Hopsital Infantil de Seattle en recibir el tratamiento, resultado anteriores en Filadelfia y Nueva York (ambos en EEUU) se acercaron al milagro: en el 90% de los pacientes con una leucemia linfoblástica aguda que vuelve a producirse y que se resiste a los tratamientos convencionales, el cáncer se elimina. Las probabilidades de que remita el cáncer en estas circunstancias es normalmente inferior al 10%.
Esos resultados explican que una empresa llamada Juno Therapeutics recaudase 304 millones de dólares (unos 267 millones de euros) al salir a bolsa en diciembre, solo 16 meses después de su constitución. En un golpe maestro de la oportunidad, los emprendedores y consejeros que fundaron Juno con los tratamientos en desarrollo en el Hospital Infantil de Seattle, el Centro de Investigaciones del Cáncer Fred Hutchinson, y hospitales de Nueva York y Memphis llevaron la cura del cáncer en potencia al público en medio de un mercado alcista para la biotecnología y para la inmunoterapia en particular. Su OPI fue de las más grandes ofertas de bolsa de la historia de la industria de la biotecnología.
Las terapias de células-T son de las más radicales de una serie de nuevos enfoques que reclutan al sistema inmunológico para que ataque al cáncer. Una idea antigua que en algún momento dado parecía un callejón sin salida, la inmunoterapia ha resurgido con resultados deslumbrantes durante los últimos cuatro años. Medicamentos recién comercializados llamados inhibidores de los puntos de control están curando un pequeño porcentaje de cánceres de piel y pulmón, que antaño representaban casos sin esperanzas de curación. Más de 600.000 personas se han tratado con estos medicamentos, comercializados por Merck y Bristol-Meyers Squibb.
Los tratamientos funcionan por medio de la eliminación de frenos moleculares que normalmente previenen que las células-T del cuerpo identifiquen al cáncer como enemigo, y han ayudado a demostrar que el sistema inmunológico es capaz de destruir al cáncer. La tecnología de Juno para la modificación de las células-T para guiar su actividad está aún en una fase anterior, más experimental. En el momento de su OPI, Juno ofrecía datos de tan sólo 61 pacientes de leucemia o linfoma.
Juno está ubicada en South Lake Union, un barrio de Seattle dominado por Amazon.com, cuyo director ejecutivo, Jeff Bezos, fue un inversor temprano de la empresa. Durante un día en los laboratorios y oficinas de Juno en mayo, la frase que escuché repetida una y otra vez fue "prueba de principios". Esto es que lo han proporcionado casos como el de Wright. Los estudios son pequeños, sin grupos de control ni comparaciones, pero tampoco sin otra explicación que las células-T de por qué desaparece el cáncer. "Se ha demostrado que el fármaco es la célula-T", dice un antiguo ejecutivo de Bayer y el actual director de Juno, Hans Bishop.
Bishop argumenta que la medicina está entrando en una nueva fase en la que las células se convertirán en medicamentos vivos. Es el tercer pilar de la medicina. Las farmacéuticas que surgieron de la química sintética constituyen el primer pilar. Entonces, después de que Genentect produjera insulina dentro de una bacteria en 1978, llegó la revolución de los medicamentos de proteínas. Ahora empresas como Juno esperan utilizar nuestras propias células como tratamiento. En el caso de las células-T, las prometedoras pruebas indican que algunos cánceres podrían tratarse con pocos efectos secundarios aparte de una fiebre alta.
La medicina entre en una nueva fase en la que las células se convertirán en medicamentos vivos.
Avanzar más allá de la prueba de principios no será tarea fácil. Nadie ha fabricado nunca un tratamiento celular de relevancia comercial. No está claro cuál sería la mejor manera de producir y suministrar tratamientos tan personalizados. Ni tampoco está claro si las células-T genéticamente modificadas pueden tratar un amplio abanico de cánceres; este año Juno y otros están lanzando nuevos estudios para averiguar precisamente esto. Incluso con la leucemia, el cáncer que ataca la médula ósea y la sangre, es aún demasiado pronto para declarar que existe cura. La mayor parte de los pacientes en tratamiento sólo llevan tratándose los últimos 12 meses. Alrededor de un 25% han visto como el cáncer reaparece, a veces mutado de una manera que lo vuelve inmune a las células-T. A los 18 meses de finalizar su tratamiento, Wright, que espera convertirse en policía, es uno de los supervivientes más longevos.
Juno no es la única empresa que persigue la idea de la células-T. Más de treinta empresas han empezado pruebas clínicas o las están planificando, incluida Novartis, que afirma que puede que pida autorización para un tratamiento rival para la leucemia en 2016. El verano pasado la FDA (Administración de Alimentos y Medicamentos de EEUU, de sus siglas en inglés) concedió a Novartis y a Juno una clasificación de "designación de avance", lo que significa que sus tratamientos para la leucemia podrían ser aprobados para su comercialización tras una sola prueba clínica – de mayor envergadura – más.
Si se mantienen los resultados iniciales, las pruebas de células-T modificadas para tratar cánceres de la sangre podrían representar una de las aprobaciones más rápidas de la historia del desarrollo de medicamentos. Podría durar un total de tan sólo siete años, mientras que el medicamento medio suele tardar unos 14 años. "Esto es inaudito en esta industria”, dice el director de genética y terapias celulares de Novartis, Usman Azam.

El CEO de Juno Therapeutics, Hans Bishop, habla con los empleados en Seattle. La empresa realizó una enorme OPI el pasado diciembre.
En Juno, conocí al director financiero, Steven Harr, que antes de unirse a la empresa era banquero inversionista de Morgan Stanley especializado en la biotecnología. Le pregunté si había prestado atención a las empresas de terapias celulares mientras trabajaba en Wall Street. "No", contestó. Justo al contrario. Se las veía como perros que persiguen una idea que no funciona – y aunque funcionasen, sería algo demasiado difícil de comercializar. La FDA enumera 14 empresas con terapias celulares aprobadas, la mayoría de las cuales constan de injertos de piel o el almacenamiento del cordón umbilical.
Pero Harr dice que "se subió al carro" cuando vio los datos de los pacientes de leucemia. Ahora cree que Juno encontrará una ventaja económica con la resolución del difícil problema de cómo comercializar tratamientos celulares. "Es algo vivo – no es lo mismo que una pastilla", afirma.
El tratamiento
"Lo pusieron por las nubes, como si fuera a ser algo increíble", recuerda Wright. Se había apuntado en seguida a las pruebas clínicas, pero no informó a nadie de su estancia en el hospital. Su madre le enviaba mensajes que decían, "¿Dónde estás? ¿Qué pasa?". Después de varios días, confesó. "Estoy en el Infantil de Seattle. Me están preparando para unas pruebas". Wright pasó por un proceso de dos horas conocido como la leucaférisis, en el cual su sangre se pasó por un dispositivo para aislar las células-T. Las células fueron enviadas al laboratorio donde una nueva cadena de ADN fue insertada en ellas mediante un virus. A las dos semanas recibió el tratamiento: un goteo de 10 minutos desde una bolsa intravenosa para volver a infundir las células a su cuerpo. Un paseo comparado con la quimioterapia. Y al principio, no ocurrió nada.
Un signo de la potencia de los tratamientos de células-T es que la mayoría de los pacientes sufren del "síndrome de liberación de citoquinas", una tormenta de moléculas generadas mientras las células combaten el cáncer. Al menos siete pacientes han fallecido a consecuencia de este síndrome. Los médicos de Wright le monitorizaban con frecuencia, buscando indicios de fiebre, lo que indicaría que las células-T estaban funcionando. "Me metían presión – 'Venga, llámanos'", recuerda. Dos semanas más tarde, la fiebre se presentó como una gripe bestial. Se le ingresó en la UCI, y dice que apenas estaba lúcido cuando los sonrientes médicos le anunciaron que eran incapaces de encontrar ningún indicio de cáncer en su organismo.
Carl June, el médico de la Universidad de Pennsylvania (EEUU) que dio publicidad a algunos de los primeros tratamientos exitosos de células-T modificadas, compara lo que sucede dentro del cuerpo de los pacientes a "un asesino en serie" y "los asesinatos masivos". Mientras se multiplican las miles de millones de células-T contenidas en una dosis, pueden localizar y eliminar varios kilos de tejido tumoral.

Un trabajador mezcla un vial de células. El coste de la preparación de una dosis de células-T puede oscilar entre los 50.000 y 75.000 dólares (entre unos 44.000 y 66.000 euros).
Eso es algo que no hacen las células-T normales. Una razón es que están entrenadas para no dañar al cuerpo, un efecto conocido como la tolerancia. El entrenamiento se efectúa en el timo, el órgano por el que reciben su nombre las células-T. Cada célula está repleta de miles de copias de un solo receptor, y su forma es generada al azar por ADN aleatorio (existen un trillón de disposiciones posibles). Las células-T cuyo receptor se fije fuertemente a moléculas marcadoras en la superficie celular, llamadas antígenos, del propio cuerpo se descartan. El resto salen de patrulla en busca de virus o bacteria de aspecto ajeno o células infectadas, se adhieren a ellos y los destruyen. "El problema es que el cáncer eres tú", dice el investigador del Centro de Investigaciones del Cáncer del Hospital Memorial Sloan Kettering, y uno de los fundadores científicos de Juno, Michel Sadelain. "Los antígenos del cáncer simplemente no son tan grandes y jugosos".
El mérito de la idea de sortear la tolerancia con una célula-T modificada se atribuye a un científico israelí llamado Zelig-Eshhar. En un estudio publicado en 1989 en la revista Proceedings of the National Academy of Sciences, reemplazó el receptor natural de las células-T con uno de su elección. Eshhar se dio cuenta de que mediante su técnica, una célula-T podría modificarse para conseguir que se fijara a cualquier cosa a que se le mandara fijar.
Es una idea tan peligrosa como poderosa, porque pocos antígenos aparecen exclusivamente en células cancerígenas. En 2009, una mujer que recibió células-T modificadas para reconocer el cáncer de colon entró de repente en paro respiratorio; falleció cinco días después. Médicos del Instituto Nacional para el Cáncer se apresuraron a cancelar el estudio, concluyendo que las células-T habían encontrado su antígeno en los pulmones, y atacaron.
Científicos como Sadelain pronto fijaron sus vistas en un antígeno ideal, llamado CD19. No aparece en ningún lugar del cuerpo, salvo en las células B, el mismo tipo que las que fallan en casos de linfoma y la leucemia que afectaba a Wright. Y resulta que eliminar todas las células B de una persona no pone su vida en peligro. Con inyecciones de inmunoglobulinas, se puede vivir sin ellas durante años.
Para el 2010, médicos del Hospital Memorial Sloan Kettering, la Universidad de Pennsylvania y el Instituto Nacional para el Cáncer habían empezado a intentar tratar a pacientes de leucemia con células-T portadoras de un receptor modificado del CD19. Habían añadido otro trocito de ADN que provoca la división de las células al interior del receptor. Nadie sabe exactamente cómo provocan la división celular, pero sin ello las células-T no hacen gran cosa. Finalmente, informes de casos tempranos dieron paso a pruebas clínicas que han tratado a unos 350 pacientes de leucemia y linfoma. Los resultados son impresionantes, en parte porque son tan consistentes, a pesar de que cada laboratorio utiliza diseños ligeramente distintos de ADN.
Seguidor rápido
Los primeros resultados de la Universidad de Pennsylvania recibieron mucha atención mediática, y llamaron la atención de Novartis, la segunda farmacéutica más grande del mundo. En agosto de 2012, acordó donar 20 millones de dólares (unos 17,6 millones de euros) para la construcción de un nuevo centro de terapia celular como parte de una alianza por la que las terapias de células-T serían patrocinadas, y poseídas, por el gigante farmacéutico suizo. El acuerdo fue notable por haberse forjado en base a datos publicados de tan sólo tres pacientes, y ahora parece un chollo.
También convierte a Juno en "seguidor rápido", en la jerga de las start-ups. Fundada en agosto de 2013, es "una empresa de muchos padres", dice Lawrence Corey, un médico de enfermedades infecciosas que entonces era el presidente del Centro de Investigaciones del Cáncer Fred Hutchinson. Corey, con la ayuda del capitalista de riesgo Bob Nelsen y de Richard Klausner, el antiguo director del Instituto Nacional para el Cáncer y el actual director médico de la empresa de secuenciación de ADN Illumina, creó Juno mediante la compra de patentes y derechos de licencia de las pruebas de células-T ya en curso en Seattle y Nueva York.
Es una idea tan peligrosa como poderosa. Ha matado a al menos siete pacientes.
Desde su OPI, la cotización bursátil de sus acciones se han elevado por encima de los 6.000 millones de dólares (unos 5.300 millones de euros), reflejando las conjeturas intensas de que la células-T modificadas mostrarán constituir un nuevo método para tratar muchos tipos de cáncer, no sólo el tipo raro de leucemia que padecía Wright. Los ejecutivos de Juno creen que podrían desarrollar rápidamente nuevos diseños de células-T y así obtener "una lectura rápida" probándolas en pacientes de cáncer terminal, donde los riesgos resultan más fáciles de justificar. La empresa planea tener en curso 10 estudios de diferentes diseños de células-T para el año que viene. "Buscamos conseguir avances rompedores", dice Mark Frohlich, un médico que es el vicepresidente de estrategia de Juno. "No vamos a decir, 'Vale, dos meses de supervivencia'".

Michel Sadelain, que en la foto sale en las instalaciones del Hospital Memorial Sloan Kettering, colaboró en la realización de una de las primeras pruebas clínicas de células-T en pacientes de leucemia.
La gran interrogante es si las células-T funcionarán para otros tipos de cáncer además de los que atacan la sangre. La semana anterior a mi visita a Juno, los inversores provocaron una caída del 35% en el precio de las acciones después de que Novartis y la Universidad de Pennsylvania informaran de que las bajas dosis de células-T modificadas no causaron casi ningún efecto en cinco pacientes de cáncer de páncreas, ovarios ni pulmón.
Aun así, los datos fueron demasiado preliminares para indicar gran cosa. "Sabemos que es viable. Pero, ¿a cuántos tipos de cáncer se puede aplicar este método? Eso no lo sabemos aún", dice Sadelain. "Lo que ha cambiado es que ahora todos saben cómo se hace. Creo que eso explica en parte el frenesí que rodea las células-T".
El meta es encontrar el próximo CD19. Pero no será tarea fácil. Puesto que pocos antígenos aparecen únicamente en células tumorales, cualquier célula-T modificada corre el riesgo de destruir órganos vitales, como le sucedió a la paciente de cáncer de colon en 2009. El Comité Asesor de ADN Recombinante, un organismo federal estadounidense que supervisa las terapias genéticas, convocó una reunión en junio para debatir cómo los científicos pensaban evitar estos, y otros, efectos secundarios.
Una manera de disminuir el riesgo ya se está probando con pacientes: "interruptores suicidas", que permiten a los médicos matar rápidamente todas las células-T modificadas en caso de surgir cualquier problema grave. Esta primavera, Michael Jensen, un médico especializado en cáncer infantil del Hospital Infantil de Seattle cuyo centro de terapia celular trató a Wright, comenzó un estudio sobre el tratamiento de la neuroblastoma, el cáncer más común entre los bebés. Dice que las células-T se dirigirán a un antígeno que se encuentra dentro de las células nerviosas. Si las células-T provocaran daños no esperados, pueden inhabilitarse con una dosis del medicamento Erbitux.
La seguridad no constituye el único obstáculo. ¿Cómo conseguir que las modificadas células-T permanezcan dentro del cuerpo humano para suministrar una protección permanente? Hasta ahora no parecen permanecer mucho tiempo en muchos pacientes, algo que Frohlich denomina "un gran problema". Y los tumores densos ubicados en órganos pueden saturar su entorno de señales, como una molécula llamada PD-L1 que desactiva las células-T. Esta defensa es el proceso en el que interfieren los inhibidores de punto de control, los nuevos medicamentos inmunoterapéuticos comercializados por Merck y Bristol-Meyers Squibb. Pero la modificación genética puede ofrecer soluciones inteligentes también. Jensen dice que reconfiguró el ADN de las células-T para que esta señal de "apagado" sirva para que ataquen con más fuerza.
Jensen es optimista acerca de la capacidad de las tecnologías de modificación genética, y las que se emplean para manipular y cultivar células, que mejoran con mucha rapidez de facilitar a los investigadores la conquista de los tumores sólidos. "Lo que tenemos ahora en la clínica para la leucemia es la versión 1.1 de este sistema operativo", dice. "Pero en el laboratorio, esa [versión] se ha quedado ya anticuada”.
Puesto que hemos tardado 20 años en conseguir resultados para la leucemia, me comentó Sadelain, "sería ingenuo esperar un avance rompedor cada cuatrimestre". Pero una docena de estudios recién lanzados de células-T indican que podrían avecinarse algunos resultados importantes.
Un estudio del que oí hablar está siendo liderado por Marcela Maus, una oncóloga de la Universidad de Pennsylvania, que este año probó las células-T modificadas en cinco pacientes con glioblastoma, un cáncer cerebral sin cura. Al practicarle una cirugía a uno de estos pacientes, Maus descubrió que el tumor se había eliminado en su mayor parte. No quedó ninguna célula del marcador objetivo. ¿Así que esto demostraba que las células-T pueden emplearse con éxito para tratar los cánceres cerebrales también? Maus es reacia a contestar esa pregunta. "Podría ser", dice. Es sencillamente demasiado pronto para saber si alguno de estos pacientes sobrevivirá más tiempo que si no hubieran recibido el tratamiento, o no. "Es díficil ejercitar la paciencia, pero eso es lo que tenemos que hacer", afirma.
Obstaculos comerciales
Cuando se le extrajo los glóbulos blancos a Wright hacia finales del 2013, fueron enviados a unas instalaciones de procesado en el Hospital Infantil de Seattle. Trabajadores portando máscaras y trajes de seguridad los colocaron en bioreactores y emplearon un virus para insertar el ADN nuevo. Entonces las células fueron cultivadas durante 10 días dentro de sacos de plástico y alimentadas con suero de sangre humana. Si media docena de centros académicos no hubiesen construido salas especializadas y limpias como esta, no existirían pruebas clínicas ni OPI. Pero el centro de Jensen no es una operación comercial: puede preparar células para tan sólo 10 pacientes al mes, y el coste por paciente asciende hasta 75.000 dólares (unos 66.000 euros) por paciente.
"No existe un modelo de coste. Pero recuerda, podemos pronunciar palabras como ‘cura’".
Jensen dice que la cuarta parte de los niños cuyos padres quieren apuntarles en el estudio de Seattle no son aceptados. A veces los motivos son médicos, pero no siempre: la capacidad es sencillamente limitada. "Quisiera poder dárselo a todos los niños", dice Jensen del tratamiento celular. "El mayor obstáculo está en el lado comercial – la construcción de fábricas, la realización de las pruebas, y el que constituya algo que pueda recetar un médico desde cualquier rincón del país”.

El médico especialista en cancer Michael Jensen lidera un programa de inmunoterapia del Hospital Infantil de Seattle.
De hecho, nadie está seguro de cómo una terapia personalizada celular se comercializará a gran escala. Esquemas que describen cómo funcionaría normalmente muestran no sólo una docena de pasos de laboratorio complejos sino también dos aviones: para el transporte de células entre pacientes y centros de terapia. Eso explica por qué la mayoría de los empleados de Juno están involucrados en la ingeniería de procesos. Uno de ellos, Chris Ramsborg, me dio una visita guiada por lo que él llama "el arenero" donde se trabajan las nuevas ideas para el cultivo y empaquetamiento de las células. Pero casi ningún equipo estaba a la vista. "La tecnología de fabricación y cómo lo desplegamos es el mayor secreto de Juno", dijo. "Las técnicas para fabricar estos productos realmente no existe aún".
Varios empleados de Juno, incluido Ramsborg, Frohlich y Hans Bishop trabajaron anteriormente para otra empresa de biotecnología de Seattle llamada Dendreon, que desarrolló un tratamiento de células-T para el cáncer de próstata. (Las células, en vez de ser modificadas, fueron expuestas a antígenos de cáncer y después multiplicadas.) Aunque Dendreon cobraba 93.000 dólares por su tratamiento (unos 82.000 euros), los costes de producción equivalen la mitad de ese precio. La empresa se declaró en quiebra el año pasado.
La planta de fabricación de Dendreon en Nueva Jersey (EEUU), que ha empezado a utilizar para procesar células de pacientes participantes en su estudio sobre la leucemia. Azam dice que Novartis, que tiene 400 empleados trabajando en la terapias genéticas y celulares, ya está estudiando la logística de cómo se podría ofrecer una terapia personalizada celular a nivel mundial. "Hemos estado mapeando cómo sería el camino recorrido por el paciente, y el camino recorrido por las células individuales", dice. "Supone una nueva forma de tratar a pacientes, pero también una nueva manera de hacer negocios".
Algun día podría ser posible producir a gran escala células-T listas para usar, o incluso realizar la modificación genética junto a la cama de un paciente. Algunos laboratorios están trabajando con instrumentos para bombear material genética al interior de las células mediante la electricidad o la presión. Otros han demostrado que pueden generar células-T en una placa de laboratorio y emplearlas para curar ratones, elevando las posibilidades de fábricas de células-T. Por ahora, sin embargo, todos los tratamientos de células-T modificadas en pruebas clínicas utilizan las células del propio paciente.
Entonces, ¿cuánto costará una dosis de células inmunológicas modificadas genéticamente? Un analista de Citigroup calculó que el precio podría superar los 500.000 dólares (unos 440.000 euros). Eso sería más caro que casi cualquier medicamento para el cáncer existente. Pero podría considerarse barato si un goteo de 10 minutos fuese capaz de tratar la leucemia de forma eficaz sin causarle daños permanentes al paciente. Los tratamientos actuales de quimioterapia duran un año o más, y pueden debilitar el cuerpo y corazón del paciente de por vida. Las facturas médicas de los pacientes de leucemia pueden superar los 2 millones de dólares (unos 1,8 millones de euros).
Harr, el director financiero de Juno, era bien conocido en Wall Street por sus críticas sobre el precio elevado de los medicamentos para tratar el cáncer; él advirtió de que el Gobierno podría intervenir para fijar los precios si no se mantuviesen bajo control. Cuando le pregunté acerca de los tratamientos de células-T, dijo que aún era demasiado pronto para adivinar el precio. Depende de su eficacia y la dificultad que entrañe su producción. "No existe un modelo para fijar el precio", dijo. "Pero recuerda, podemos pronunciar palabras como ‘cura’. Y hoy por hoy, es una única dosis".


