
Biotecnología
Más allá de Frankenstein: los avances para acabar con el estigma de la medicina eléctrica
La "electrocéutica" prometía ser el futuro posfarmacéutico de la medicina. Pero el enfoque exclusivo en el sistema nervioso parece cada vez menos justificado
A principios de la década de 2010, la electricidad parecía estar a punto de invadir la consulta del médico. La investigación sobre cómo el sistema nervioso controla la respuesta inmunitaria estaba ganando terreno. Y eso había abierto la puerta a la posibilidad de hackear los circuitos del cuerpo y controlar así una serie de enfermedades crónicas, como la artritis reumatoide, el asma y la diabetes, como si el sistema inmunitario fuera tan reprogramable como un ordenador.
Para ello se necesitaría una nueva clase de implante: un "electrocéutico", presentado formalmente en un artículo en Nature en 2013. "Lo que estamos haciendo es desarrollar dispositivos que sustituyan a los fármacos", explicó a Wired UK el coautor y neurocirujano Kevin Tracey. Estos se convertirían en un "pilar del tratamiento médico". Se acabaron los molestos efectos secundarios. Y se acabaron las conjeturas sobre si un fármaco funcionaría de forma diferente para una u otra persona.
Había dinero detrás de esta visión: el gigante farmacéutico británico GlaxoSmithKline anunció un premio de investigación de un millón de dólares (unos 919.700 euros), un fondo de riesgo de 50 millones de dólares (en torno a 46 millones de euros) y un ambicioso programa para financiar a 40 investigadores que identificaran vías neuronales que pudieran controlar enfermedades específicas. Y la empresa tenía en mente un calendario agresivo. En palabras de un ejecutivo de GlaxoSmithKline, el objetivo era tener "el primer medicamento que hable el lenguaje eléctrico de nuestro cuerpo listo para su aprobación a finales de esta década".
En los diez años transcurridos desde entonces, se han invertido en torno a mil millones de dólares (casi 920 millones de euros) en financiación directa e indirecta. Algunos implantes desarrollados en ese impulso electrocéutico han entrado en ensayos clínicos, y dos empresas afiliadas a GlaxoSmithKline y Tracey se preparan para hacer anuncios sonados a finales de este año. Aún no sabemos mucho sobre el éxito de los ensayos en curso. Pero la aprobación reglamentaria generalizada de la clase de dispositivos previstos en 2013 —dispositivos que pudieran aplicarse a una amplia gama de enfermedades crónicas— no es inminente. Los electrocéuticos están muy lejos de fomentar una revolución en la atención médica.
Al mismo tiempo, un nuevo campo de la ciencia ha empezado a articularse en torno a otra forma de utilizar la electricidad para intervenir en el organismo. En lugar de centrarse únicamente en el sistema nervioso —la autopista que transporta los mensajes eléctricos entre el cerebro y el cuerpo—, un número creciente de investigadores está encontrando formas inteligentes de manipular eléctricamente células de otras partes del cuerpo, como las de la piel y los riñones, de forma más directa que nunca. Sus trabajos sugieren que este enfoque podría igualar las primeras promesas de los electrocéuticos, dando lugar a vendajes bioeléctricos de curación rápida, nuevos enfoques para tratar trastornos autoinmunes, nuevas formas de reparar daños nerviosos e incluso mejores tratamientos contra el cáncer. Sin embargo, estas empresas no se han beneficiado de la generosidad de los inversores, que tienden a entender la relación entre biología y electricidad solo en el contexto del sistema nervioso. "Estas suposiciones proceden de prejuicios y puntos ciegos que se han ido horneando durante 100 años de neurociencia", afirma Michael Levin, investigador de bioelectricidad de la Universidad de Tufts (Boston, Massachusetts, EE UU).
Los implantes eléctricos ya han tenido éxito en el tratamiento de problemas específicos como la epilepsia, la apnea del sueño y la disfunción intestinal catastrófica. Pero la visión más amplia de sustituir los fármacos por dispositivos que activen los nervios, especialmente los que alteran el sistema inmunitario, ha tardado más en materializarse. En algunos casos, quizá el sistema nervioso no sea la mejor vía de entrada. Mirar más allá de este punto de control único podría abrir el camino a un conjunto más amplio de intervenciones electromédicas, sobre todo si el sistema nervioso se muestra menos susceptible de ser hackeado de lo que se había anunciado en un principio.
Cómo empezó todo
La ambiciosa aventura electrocéutica de GSK fue una respuesta a un problema cada vez más oneroso: el 90% de los fármacos fracasan en la carrera de obstáculos que suponen los ensayos clínicos. Un nuevo fármaco que lo consiga puede costar 2.000 o 3.000 millones de dólares (entre 1.840 y 2.760 millones de euros, aproximadamente) y tardar entre 10 y 15 años en salir al mercado, lo que supone un retorno de la inversión exasperante. El fallo está en el sistema de administración. La forma en que administramos las sustancias químicas curativas no ha sufrido grandes cambios conceptuales desde el médico renacentista Paracelso: ingerir o inyectar. Ambos métodos son ineficaces: los fármacos tardan mucho tiempo en acumularse en el organismo y pueden dispersarse mucho antes de llegar diluidos a su destino, lo que puede hacerlos inútiles donde se necesitan y tóxicos en otros lugares. Tracey y Kristoffer Famm, coautor del artículo de Nature y entonces vicepresidente de GlaxoSmithKline, explicaron en el circuito publicitario que los electrocéuticos resolverían estos problemas, actuando más rápidamente y solo en el lugar preciso donde se necesitaba la intervención. Después de 500 años, por fin había una idea nueva.
Bueno... más o menos nueva. La estimulación eléctrica del sistema nervioso había cosechado prometedores éxitos desde mediados del siglo XX. Por ejemplo, los síntomas de la enfermedad de Parkinson se habían tratado mediante estimulación cerebral profunda, y el dolor intratable, mediante estimulación espinal. Sin embargo, estas intervenciones no podían realizarse a la ligera: los implantes debían colocarse en la columna vertebral o el cerebro, una perspectiva desalentadora. En otras palabras, esta idea nunca sería rentable.
Lo que entusiasmó a GSK fueron las pruebas recientes de que la salud podía controlarse de forma más amplia y mediante nervios a los que era más fácil acceder. En los albores del siglo XXI, estaba claro que se podía intervenir en el sistema nervioso con menos riesgos y más beneficios. Esto se debe a los descubrimientos que sugieren que el sistema nervioso periférico —esencialmente, todo excepto el cerebro y la columna vertebral— tiene una influencia mucho mayor de lo que se creía.
Durante mucho tiempo se había creído que el sistema nervioso periférico solo tenía una función: la percepción sensorial del mundo exterior. Esta información se transporta al cerebro a través de muchos pequeños afluentes neuronales que surgen de las extremidades y los órganos, la mayoría de los cuales convergen en una única vía principal en el torso: el nervio vago.
A partir de la década de 1990, las investigaciones de Linda Watkins, neurocientífica que dirige un equipo en la Universidad de Colorado en Boulder (EE UU), sugirieron que esta superautopista principal del sistema nervioso periférico no era, después de todo, una vía de sentido único. Al parecer, transportaba mensajes en ambas direcciones, no solo hacia el cerebro, sino desde el cerebro hacia todos esos órganos. Además, parece que este enlace de comunicaciones permite al cerebro ejercer cierto control sobre el sistema inmunitario, por ejemplo, avivando la fiebre en respuesta a una infección.
Y a diferencia del cerebro o la médula espinal, el acceso al nervio vago es relativamente fácil: su camino hacia y desde el tronco encefálico discurre cerca de la superficie del cuello, a lo largo de un gran cable a cada lado. Basta con ponerle un electrodo —generalmente en la rama izquierda— y empezar a enviar impulsos eléctricos.
Interviniendo de este modo en el flujo del nervio vago en dirección ascendente se habían tratado con éxito problemas cerebrales, en concreto la epilepsia y la depresión resistente al tratamiento (y los implantes eléctricos para estas aplicaciones fueron aprobados por la FDA —la Administración de Alimentos y Medicamentos de EE UU, por sus siglas en inglés— en torno al cambio de milenio). Pero los conocimientos del equipo de Watkins pusieron en juego la dirección descendente.
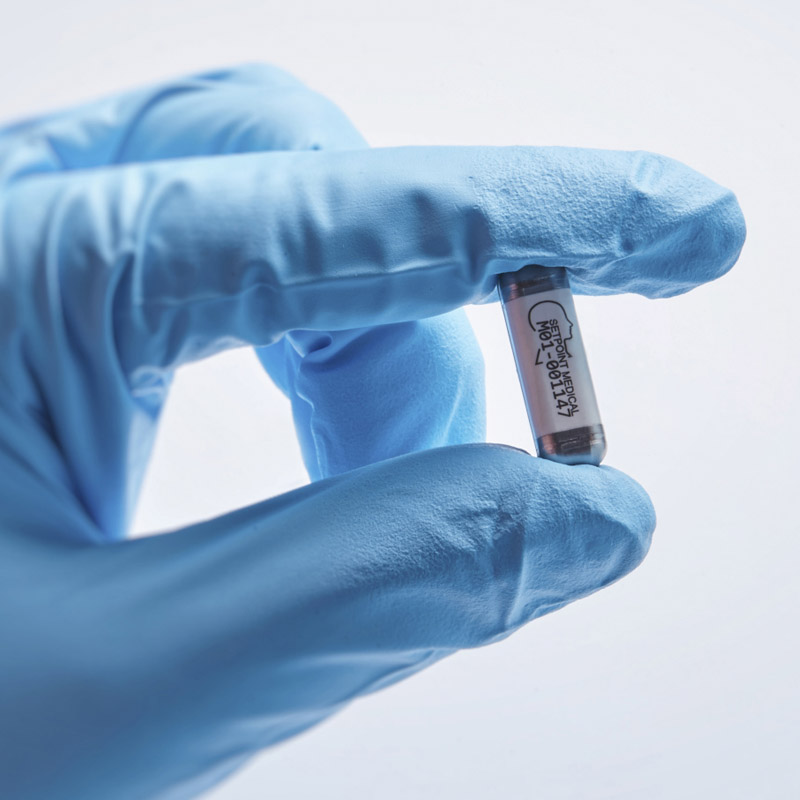
Fue Kevin Tracey quien unió todos estos puntos, tras lo cual no tardó en convertirse en la cara pública de la investigación sobre la estimulación del nervio vago. En la década de los 2000, demostró que la estimulación eléctrica del nervio calmaba la inflamación en animales. Este "reflejo inflamatorio", como llegó a llamarlo, implicaba que el nervio vago podía actuar como un interruptor capaz de desactivar una amplia gama de enfermedades, básicamente hackeando el sistema inmunitario. En 2007, mientras trabajaba en lo que hoy se conoce como los Institutos Feinstein de Investigación Médica, en Nueva York (EE UU), puso en marcha una empresa de Boston (Massachusetts, EE UU) llamada SetPoint Medical. Su objetivo era desarrollar dispositivos que activaran este interruptor y proporcionaran alivio, empezando por la enfermedad inflamatoria intestinal y la artritis reumatoide.
En 2012, se había desarrollado una relación coordinada entre GSK, Tracey y las agencias gubernamentales estadounidenses. Tracey dice que Famm y otros contactaron con él "para que les ayudara en ese artículo de Nature". Un año después, la hoja de ruta de los electrocéuticos estaba lista para ser presentada al público.
La historia que los investigadores contaban sobre el futuro era elegante y sencilla. La ilustraba una anécdota que Tracey relataba con frecuencia en el circuito publicitario, la del primer caso de estudio en humanos, que SetPoint había coordinado en el Centro Médico Académico de la Universidad de Ámsterdam (Países Bajos). El equipo había implantado un estimulador del nervio vago en un hombre con artritis reumatoide. La estimulación hizo que su bazo liberara una sustancia química llamada acetilcolina. Esta, a su vez, indicaba a las células del bazo que desactivaran la producción de unas moléculas inflamatorias llamadas citocinas. Para este hombre, el método funcionó lo bastante bien como para permitirle reanudar su trabajo, jugar con sus hijos e incluso retomar sus antiguas aficiones. De hecho, su excesivo entusiasmo por retomar sus antiguas actividades le provocó una lesión deportiva, como Tracey se complacía en relatar para periodistas y en conferencias.
Estos casos prácticos abrieron el grifo del dinero. La combinación de una gama más amplia de objetivos patológicos y objetivos quirúrgicos menos arriesgados era el lenguaje del amor de los inversores. Mientras que la estimulación cerebral profunda y otros implantes invasivos se habían limitado a problemas raros, oscuros y catastróficos, esta nueva interfaz con el cuerpo prometía muchos más clientes: las enfermedades crónicas ahora sobre la mesa son mucho más prevalentes, incluyendo no solo la artritis reumatoide, sino también la diabetes, el asma, el síndrome del intestino irritable, el lupus y muchos otros trastornos autoinmunes. GSK puso en marcha un brazo inversor al que denominó Action Potential Venture Capital Limited, con 50 millones de dólares (unos 46 millones de euros) en las arcas para invertir en las tecnologías y empresas que harían realidad la visión futurista de los electrocéuticos. Su inversión inaugural fue una participación de 5 millones de dólares (4,6 millones de euros) en SetPoint.
Si uno fuera supersticioso, lo que ocurrió a continuación podría parecer un presagio. La palabra "electrocéutico" ya pertenecía a alguien: una empresa llamada Ivivi Technologies la había registrado en 2008. "Estoy bastante seguro de que les enviamos una carta poco después de que iniciaran la campaña para alertarles de nuestra marca", afirma Sean Hagberg, cofundador y entonces director científico de la empresa. En la actualidad, ni GSK ni SetPoint pueden denominar oficialmente su tecnología "electroceútica", y ambas se refieren a los implantes que están desarrollando como "medicina bioelectrónica". Sin embargo, este término engloba una amplia gama de intervenciones, algunas bastante consolidadas, como los implantes cerebrales, los implantes de columna vertebral, la estimulación del nervio hipogloso para la apnea del sueño (dirigida a un nervio motor que pasa por el vago) y otros implantes del sistema nervioso periférico, incluidos los destinados a personas con trastornos gástricos graves.

El siguiente problema no tardó en aparecer: cómo actuar sobre el nervio correcto. El nervio vago tiene unas 100.000 fibras apretadas en su interior, explica Kip Ludwig, que entonces trabajaba en los Institutos Nacionales de Salud de EE UU (NIH, por sus siglas en inglés) y ahora codirige el Instituto Wisconsin de Neuroingeniería Traslacional de la Universidad de Wisconsin-Madison (EE UU). Estas innumerables fibras están conectadas a muchos órganos distintos, como la laringe y las vías respiratorias inferiores, y los campos eléctricos no son lo bastante precisos como para afectar a una sola de ellas sin afectar a muchas de sus vecinas (en palabras de Ludwig, "los campos eléctricos [son] realmente promiscuos").
Esto explica por qué transmitir una corriente eléctrica generalizada a todo el haz se ha asociado durante mucho tiempo con "efectos sobre el objetivo" impredecibles y "efectos fuera del objetivo" desagradables, que es otra forma de decir que no siempre funcionaba y podía conllevar efectos secundarios que iban desde los irritantes, como una tos crónica, a los que alteran la vida, incluyendo dolores de cabeza y una falta de aliento mejor descrita como hambre de aire. Identificar las fibras que conducen a un órgano concreto también resultaba difícil por otro motivo: los mapas existentes del sistema nervioso periférico humano eran antiguos y bastante limitados. Un mapa de carreteras de tan baja resolución no bastaría para llevar una señal desde la autopista hasta su destino.
En 2014, para remediar esta situación y avanzar en general en el campo de la estimulación nerviosa periférica, los NIH anunciaron una iniciativa de investigación conocida como SPARC —Stimulating Peripheral Activity to Relieve Conditions, "Estimular la actividad periférica para aliviar afecciones"— con el objetivo de destinar 248 millones de dólares (algo más de 228 millones de euros) a la investigación de nuevas formas de explotar las vías eléctricas del sistema nervioso para la medicina. "Mi trabajo", dice Gene Civillico, que dirigió el programa hasta 2021, "era hacer un programa relacionado con la electrocéutica que utilizó las opciones de política NIH que estaban disponibles para nosotros para tratar de hacer que algo catalizador suceda." La idea era hacer mapas anatómicos neuronales y explorar las consecuencias de seguir varios caminos. Una vez cartografiados los órganos, dice Civillico, el siguiente paso era averiguar qué circuito nervioso los estimularía y decidir un punto de acceso: "Y el punto de acceso debía ser el nervio vago, porque ahí es donde está el mayor interés".
Dos años después, cuando SPARC empezó a distribuir sus fondos, las empresas avanzaron en sus planes para la primera generación de implantes. GSK se asoció con Verily (antes Google Life Sciences) en una iniciativa de investigación de 715 millones de dólares (unos 658 millones de euros) que llamaron Galvani Bioelectronics, con Famm al frente como presidente. SetPoint, que se había trasladado a Valencia (California, EE UU), se mudó a una ubicación ampliada, un campus que antes había albergado una instalación secreta de I+D de Lockheed.
Cómo va la cosa
Diez años después de que los electrocéuticos entraran (y luego salieran rápidamente) del léxico, el programa SPARC ha aportado información importante sobre las particularidades eléctricas del sistema nervioso periférico. Sus mapas han iluminado nodos atractivos desde el punto de vista quirúrgico y relevantes desde el punto de vista médico. Ha financiado una constelación mundial de investigadores académicos. Pero sus conocimientos serán útiles para la próxima generación de implantes, no para los que se están probando en la actualidad.
Los implantes actuales, de SetPoint y Galvani, serán noticia este mismo año. Aunque SetPoint calcula que un estudio ampliado de su ensayo clínico de fase III concluirá en 2027, los resultados primarios se darán a conocer este verano, afirma Ankit Shah, un vicepresidente de marketing de SetPoint. Y aunque el ensayo de Galvani concluirá en 2029, afirma Famm, la empresa está "llegando a un punto emocionante" y publicará los datos de los pacientes más adelante en 2024.
Los resultados podrían interpretarse como un referéndum sobre los distintos enfoques de las dos empresas. Ambos dispositivos tratan la artritis reumatoide y se dirigen al sistema inmunitario a través del sistema nervioso periférico, pero ahí acaban las similitudes. El dispositivo de SetPoint tiene un diseño en forma de concha que se coloca alrededor del nervio vago, en el cuello. Lo estimula durante un minuto, una vez al día. Los representantes de SetPoint afirman que nunca han visto los efectos secundarios que se han producido por el uso de estos estimuladores para tratar la epilepsia. Pero si alguien experimentara los descritos por otros investigadores —incluso vómitos y dolores de cabeza— podrían ser tolerables si solo duraran un minuto.
Pero ¿por qué no evitar por completo el nervio vago? Galvani está utilizando un implante más preciso que se dirige al "órgano terminal" del bazo. Si el nervio vago puede considerarse la autopista principal del sistema nervioso periférico, un órgano terminal es esencialmente la "entrada" de un órgano concreto. El objetivo de Galvani es el punto en el que el nervio esplénico (que se ha escindido de un sistema conectado a la autopista del vago) se une al bazo.
Para centrarse en un objetivo tan específico, la empresa ha sacrificado la facilidad de acceso. El implante, del tamaño de una llave, se inyecta por laparoscopia a través del ombligo. Famm afirma que si este método funciona en el caso de la artritis reumatoide, es probable que sirva para todos los trastornos autoinmunes. Destacando este ensayo clínico en 2022, declaró a Nature Reviews: "Esto es lo que hace que los próximos 10 años sean emocionantes".

Sin embargo, quizá lo es más para los investigadores que para los pacientes. Mientras Galvani y SetPoint preparan sus temas de debate, otros grupos financiados por SPARC siguen planteándose cuestiones de investigación que sugieren que la mejor interfaz tecnológica con el sistema inmunitario sigue siendo objeto de debate. De momento, los electrocéuticos están en el candelero, pero aún les queda mucho camino por recorrer, afirma Vaughan Macefield, neurofisiólogo de la Universidad Monash (Melbourne, Australia), cuyo trabajo se financia con una subvención SPARC más reciente de 21 millones de dólares (unos 19,3 millones de euros): "Es una idea elegante, [pero] hay opiniones encontradas".
Macefield no cree que estimular eléctricamente todo el haz sea una buena idea. Muchos investigadores están buscando formas de ser más selectivos a la hora de estimular fibras concretas del nervio vago. Algunos están diseñando nuevos electrodos que penetren en fibras concretas en lugar de pinzarlas todas. Otros intentan alcanzar el vago en puntos más profundos del abdomen. De hecho, algunos no están seguros de que la electricidad o un implante sean ingredientes necesarios de la "electrocéutica". En su lugar, están pasando de la estimulación eléctrica a los ultrasonidos.
La gran variedad de enfoques deja bastante claro que la forma final de los electrocéuticos sigue siendo una cuestión de investigación abierta. Macefield afirma que aún no se sabe a ciencia cierta cómo funciona la estimulación del nervio vago.
Sin embargo, Tracey cree que la variedad de enfoques que se están desarrollando no contraviene los méritos de la idea básica. La forma en que las empresas tecnológicas harán que esto funcione en la clínica, dice, es una cuestión comercial y de propiedad intelectual aparte: "¿Se puede hacer con ultrasonidos focalizados? ¿Se puede hacer con un dispositivo implantado con cirugía abdominal? ¿Se puede hacer con un dispositivo implantado en el cuello? ¿Se puede hacer incluso con un dispositivo implantado en el cerebro? Todas estas estrategias son posibles gracias a la idea del reflejo inflamatorio". Hasta que no se disponga de los datos de los ensayos clínicos, dice, no tiene sentido discutir sobre la mejor manera de manipular el mecanismo, y si un enfoque no funciona, eso no es un referéndum sobre la validez del reflejo inflamatorio.
Tras abandonar la junta directiva de SetPoint en 2011 para dedicarse exclusivamente a la consultoría, Tracey se centró en su trabajo de laboratorio en los Institutos Feinstein, que dirige, para profundizar en el conocimiento de esta vía. La investigación allí es muy amplia. Varios investigadores a su cargo están estudiando un tipo de manipulación indirecta no invasiva llamada estimulación transcutánea del nervio vago auricular, que estimula la piel de la oreja con un dispositivo portátil. Tracey dice que es un "malapropismo" llamar a este método estimulación del nervio vago. "No es más que un zumbador de oreja", dice. Puede estimular una rama sensorial del nervio vago, lo que puede activar el reflejo inflamatorio. "Pero nadie lo sabe", afirma. No obstante, hay varios ensayos clínicos en marcha.
"Estas cosas llevan tiempo", afirma Tracey. "Es muy difícil inventar y desarrollar algo completamente revolucionario en medicina. En la historia de la medicina, cualquier cosa verdaderamente nueva y revolucionaria tarda entre 20 y 40 años desde que se inventa hasta que se adopta de forma generalizada."
"Como descubridor de esta vía", dice, "lo que quiero ver son terapias múltiples, que ayuden a millones de personas". Esta visión dependerá de ensayos de mayor envergadura realizados a lo largo de muchos años. En el caso de los dispositivos, suelen ser tan difíciles como en el de los fármacos. Muchos resultados que parecen convincentes en los primeros ensayos decepcionan en rondas posteriores, al igual que ocurre con los fármacos. Es posible, dice Ludwig, "que superen un ensayo de corta duración de la FDA y aun así no supongan una mejora importante respecto a las soluciones farmacológicas". Incluso después de la aprobación de la FDA, en caso de que se produzca, serán necesarios más estudios para determinar si los implantes están sujetos a los mismos problemas que afectan a los fármacos, incluida la habituación.
Esta visión de los electrocéuticos parece haber puesto unos mil millones de huevos en la única cesta del sistema nervioso periférico. En cierto modo, tiene sentido. Al fin y al cabo, la opinión generalizada es que estas señales nerviosas son la única forma de ejercer el control eléctrico de las demás células del organismo. Esos otros billones —las células de la piel, las células inmunitarias, las células madre— están fuera del alcance de la intervención eléctrica directa.
Pero en los últimos 20 años ha quedado muy claro que no es así.
Otras células hablan electricidad
A finales del siglo XIX, el fisiólogo alemán Max Verworn observó cómo una criatura marina unicelular era arrastrada por la superficie de su placa como capturada por un rayo tractor. En cierto modo, lo había sido: bajo la influencia de un campo eléctrico, se dirigió hacia el cátodo (el polo que atrae la carga positiva). Muchos otros tipos de células pueden obedecer a los caprichos direccionales de un campo eléctrico, fenómeno conocido como galvanotaxis.
Pero esto era demasiado extraño para la biología, y los charlatanes ya ocupaban demasiado espacio en el diagrama de Venn donde la electricidad se encuentra con la medicina. (La asociación se formalizó en 1910 en el Informe Flexner, encargado para mejorar el pésimo estado de las facultades de medicina estadounidenses, que envió la medicina eléctrica al exilio junto con la homeopatía). Todo el mundo se olvidó educadamente de la galvanotaxis hasta los años 70 y 80, cuando resurgió el peculiar comportamiento. Levaduras, hongos, bacterias... a todos les gustaban los cátodos. "Estábamos arrastrando todo tipo de células en placas de Petri con un campo eléctrico", explica Ann Rajnicek, de la Universidad de Aberdeen (Escocia, Reino Unido), que formó parte del primer grupo de investigadores que intentó descubrir el mecanismo cuando se despertó el interés científico.
La galvanotaxis no habría llamado la atención si el comportamiento se hubiera limitado a las neuronas. Esas células han desarrollado receptores que detectan los campos eléctricos; son un aspecto fundamental del mecanismo que utiliza el sistema nervioso para enviar su información. De hecho, la razón por la que las neuronas se prestan tanto a la manipulación eléctrica es que los implantes eléctricos secuestran un mecanismo relativamente predecible. Si se estimula un nervio o un músculo, se le obliga a "hablar" un lenguaje que ya domina.
Las células no excitables, como las de la piel y los huesos, no comparten estos receptores, pero cada vez es más evidente que, de algún modo, siguen percibiendo y respondiendo a los campos eléctricos.
¿Por qué? Cada vez encontramos más razones. Por ejemplo, cada vez se sabe más que la galvanotaxis desempeña un papel crucial en la cicatrización de heridas. En todas las especies estudiadas, la lesión de la piel produce un campo eléctrico instantáneo generado internamente, y hay pruebas abrumadoras de que guía a las células de reparación hacia el centro de la herida para iniciar el proceso de reconstrucción. Pero la galvanotaxis no es la única forma en que estas células son guiadas por la electricidad. Durante el desarrollo, las células inmaduras parecen percibir las propiedades eléctricas de sus vecinas, lo que influye en su futura identidad: si se convertirán en neuronas, células cutáneas, células adiposas o células óseas.
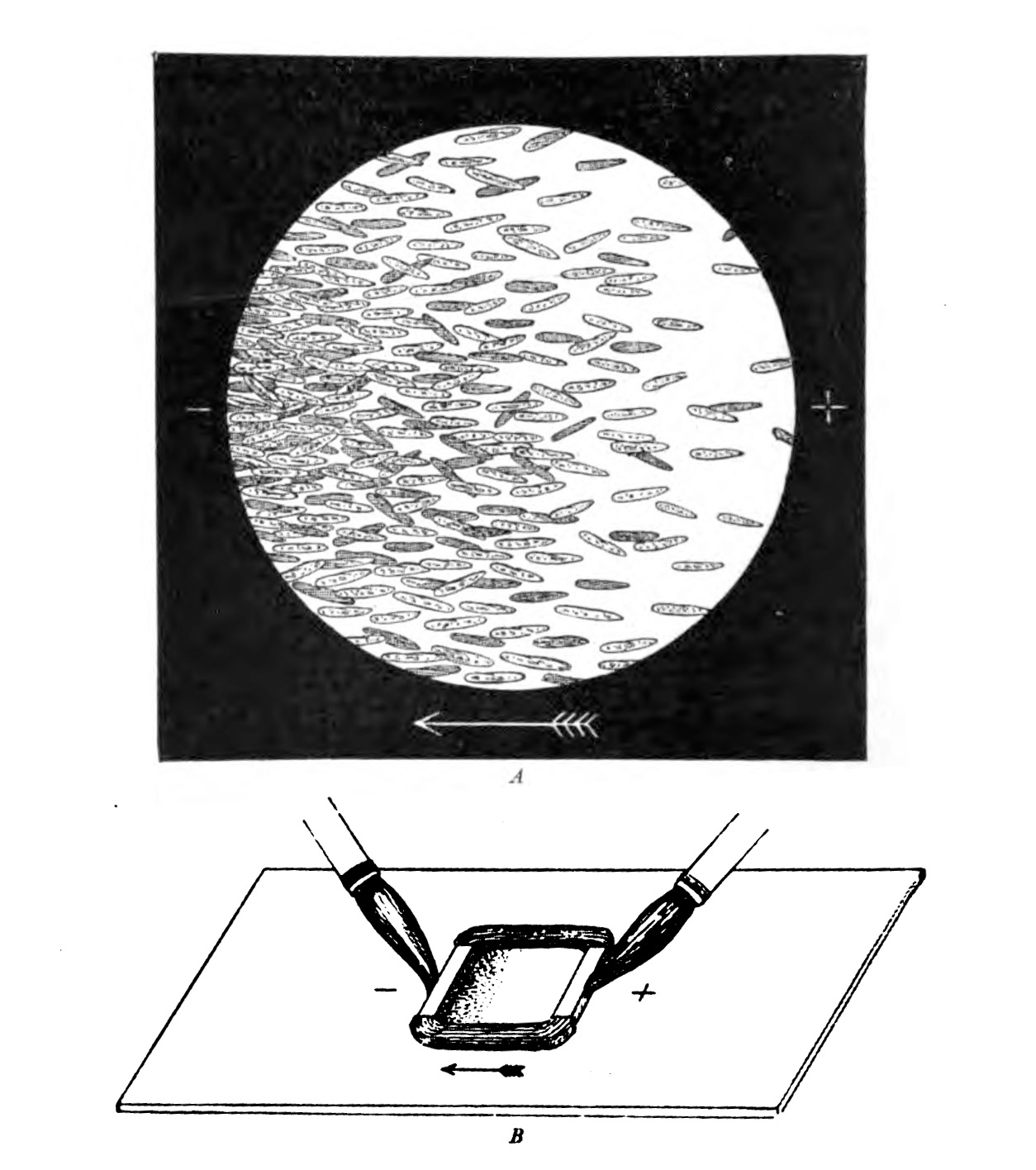
A pesar de lo intrigante de todo esto, nadie tuvo mucha suerte a la hora de convertir estos conocimientos en medicina. Incluso los intentos de seguir por la vía más prometedora, aprovechar la galvanotaxis para fabricar nuevos vendajes, resultaron infructuosos durante muchos años. "Cuando encontramos heridas difíciles de curar, resistentes y que no cicatrizan, y aplicamos un campo eléctrico, solo el 50% de los casos, más o menos, surten efecto", explica Anthony Guiseppi-Elie, investigador del Instituto Internacional de Ciencias Médicas, Ingeniería e Innovación de Estados Unidos.
Sin embargo, en los últimos años, los investigadores han encontrado formas de hacer que la estimulación eléctrica fuera del sistema nervioso no sea tanto una cuestión de azar.
Esto se debe a los constantes avances en la comprensión de cómo captan exactamente los campos eléctricos las células no neuronales, lo que ha contribuido a calmar los temores en torno al misticismo y las asociaciones Frankenstein que han acompañado a las respuestas biológicas a la electricidad.
La primera gran victoria llegó en 2006, con la identificación de genes específicos en células de la piel que se activan y desactivan con los campos eléctricos. Cuando la piel se lesiona, el campo eléctrico nativo del cuerpo orienta las células hacia el centro de la herida, y el fisiólogo Min Zhao y sus colegas descubrieron importantes vías de señalización que se activan por este campo y se movilizan para mover las células hacia este cátodo natural. También hallaron receptores asociados, y otros científicos ampliaron el catálogo de cambios en los genes y las redes de regulación génica que se activan y desactivan bajo un campo eléctrico.
Lo que ha quedado claro desde entonces es que no existe un mecanismo sencillo al final del arco iris. "Que se sepa, no hay una sola proteína maestra que regule las respuestas [a un campo eléctrico]", afirma Daniel Cohen, bioingeniero de la Universidad de Princeton (Nueva Jersey, EE UU). "Cada tipo de célula tiene un cóctel diferente de cosas que salen de ella".
Pero los últimos años han traído buenas noticias, tanto en la ciencia experimental como en la aplicada. En primer lugar, las plataformas experimentales para investigar la expresión génica están en plena transformación. El año pasado, Sara Abasi, Guiseppi-Elie y sus colegas de Texas A&M y del Instituto Metodista de Investigación de Houston (Texas, EE UU) dieron a conocer un avance: su plataforma de investigación, cuidadosamente diseñada, registraba los perfiles de expresión génica celular pertinentes y cómo cambiaban bajo campos eléctricos, en concreto, aquellos sintonizados para imitar lo que se encuentra en la biología. Encontraron indicios de la activación de dos proteínas implicadas en el crecimiento tisular, junto con un aumento de la expresión de una proteína llamada CD-144, una versión específica de lo que se conoce como cadherina. Las cadherinas son importantes estructuras físicas que permiten a las células adherirse entre sí, actuando como pequeños apretones de manos entre células. Son cruciales para que las células puedan actuar en masa en lugar de individualmente.
El otro gran avance son las herramientas que pueden revelar cómo trabajan juntas las células en presencia de campos eléctricos.
Una electrocéutica diferente
Uno de los principales límites de los experimentos anteriores era que solían probar los efectos de los campos eléctricos en células individuales o en animales enteros. Según Cohen, ninguna de las dos escalas es la adecuada para ofrecer información útil: medir esta dinámica en animales es demasiado "caótico", pero en células individuales, la dinámica es demasiado artificial para decir mucho sobre el comportamiento colectivo de las células al curar una herida. Ese comportamiento solo aparece a escalas relevantes, como las bandadas de pájaros, los bancos de peces o el tráfico de carretera. "Las matemáticas son idénticas para describir este tipo de dinámicas colectivas", afirma.
En 2020, Cohen y su equipo dieron con una solución: un dispositivo experimental que logra el equilibrio entre la célula individual (no dice casi nada) y el animal (dice demasiadas cosas a la vez). El dispositivo, llamado SCHEEPDOG, puede revelar lo que ocurre a nivel tisular, que es la escala relevante para investigar la cicatrización de heridas.
Utiliza dos conjuntos de electrodos —un poco a la manera en que se manipulan los diales de un Etch A Sketch— colocados en un biorreactor cerrado, que se aproxima mejor al funcionamiento de los campos eléctricos en biología. Con esta configuración, Cohen y sus colegas pueden ajustar con precisión el entorno eléctrico de decenas de miles de células a la vez para influir en su comportamiento.
Su posterior plataforma de "curación en un chip" dio lugar a un interesante descubrimiento: la respuesta de las células de la piel a un campo eléctrico depende de su madurez. Cuanto menos maduras, más fáciles de controlar.
¿El culpable? Las cadherinas que Abasi y Guiseppi-Elie también habían observado que cambiaban con los campos eléctricos. En las células maduras, estos pequeños apretones de manos se habían vuelto tan fuertes que un campo eléctrico competidor, en lugar de guiar suavemente a las células, hacía que se desgarraran. Las células inmaduras de la piel seguían las indicaciones del campo eléctrico sin rechistar.
Cuando encontraron la forma de reducir las cadherinas con un anticuerpo, todas las células se sincronizaron. Para Cohen, la lección fue que es más importante observar el sistema y la dinámica colectiva que rige un comportamiento como la cicatrización de heridas que lo que ocurre en una sola célula. "Esto es realmente importante porque muchos intentos clínicos de utilizar la estimulación eléctrica para acelerar la cicatrización de heridas han fracasado", dice Guiseppi-Elie, y nunca había quedado claro por qué unos funcionaban y otros no.
El equipo de Cohen trabaja ahora para traducir estos hallazgos en emplastos bioeléctricos de nueva generación. No están solos, ni mucho menos, y los beneficios no son solo a nivel de piel. Se está trabajando mucho, en parte de forma abierta y en parte a puerta cerrada, con patentes que se protegen con celo, dice Cohen.
En Stanford, la Universidad de Arizona y Northwestern (EE UU), los investigadores están creando vendas eléctricas inteligentes que pueden implantarse bajo la piel. También pueden controlar el estado de la herida en tiempo real, aumentando la estimulación si la cicatrización es demasiado lenta. Según Rajnicek, es más difícil interactuar con las zonas menos accesibles del cuerpo. Sin embargo, también aquí las nuevas herramientas están revelando soluciones creativas intrigantes.
Los campos eléctricos no tienen por qué cambiar directamente la expresión génica de las células para ser útiles. Hay otra forma de que su aplicación se convierta en un beneficio médico. Los campos eléctricos provocan especies reactivas de oxígeno (ERO) en las células biológicas. Normalmente, estas moléculas cargadas son un subproducto de las actividades metabólicas cotidianas de una célula. Sin embargo, si se inducen intencionadamente mediante una corriente continua externa, pueden ser pirateadas para que actúen a nuestro antojo.
Desde 2020, el bioingeniero suizo Martin Fussenegger y un equipo internacional de colaboradores empezaron a publicar investigaciones sobre este mecanismo para potenciar la expresión génica. Él y su equipo diseñaron células de riñón humano para que fueran hipersensibles a las ERO inducidas en cantidades que las células normales no podían percibir. Pero cuando estas se generaban mediante electrodos de corriente continua, las células renales podían percibir perfectamente las diminutas cantidades.
Con este instrumento, en 2023 fueron capaces de crear una diminuta fábrica de insulina portátil. Las células renales de diseño se crearon con un promotor sintético (una secuencia modificada de ADN que puede impulsar la expresión de un gen diana) que reaccionaba a las débiles ERO inducidas activando una cascada de cambios genéticos que abrían un grifo para la producción de insulina a demanda.
A continuación, empaquetaron este artilugio electrogenético en un dispositivo portátil que funcionó durante un mes en un ratón vivo, que había sido diseñado para ser diabético (Fussenegger afirma que "otros han demostrado que las células de diseño implantadas pueden permanecer activas durante más de un año"). Las células de diseño del wearable se mantienen vivas gracias a la gelatina de algas, pero se alimentan del propio sistema vascular del ratón, lo que permite el intercambio de nutrientes y proteínas. Las células no pueden salir, pero la insulina que segregan sí, filtrándose directamente al torrente sanguíneo del ratón. Diez segundos al día de estimulación eléctrica mediante agujas conectadas a tres pilas AAA bastaron para que el implante funcionara como un páncreas y devolviera la glucemia del ratón a niveles no diabéticos. Dado lo fácil que sería generalizar el mecanismo, Fussenegger afirma que no hay razón para que la insulina sea el único fármaco que pueda generar un dispositivo de este tipo. Fussenegger insiste en que este dispositivo portátil está en fase de prueba de concepto, pero otras personas ajenas al equipo están entusiasmadas con su potencial. Podría constituir una alternativa eléctrica más directa a la solución electrocéutica prometida para la diabetes.
Escapar del neurochovinismo
Antes del impulso concertado en torno a los electrocéuticos de marca, los esfuerzos por aprovechar el sistema nervioso periférico estaban fragmentados y no compartían muchos datos. Hoy en día, gracias a SPARC, que está en vías de desaparición, se han centralizado los recursos para compartir datos. Y los fondos, tanto directos como indirectos, para el proyecto de electrocéuticos han sido abundantes. Las terapias —especialmente la estimulación del nervio vago— han sido objeto de "un aumento constante de la financiación y el interés", afirma Imran Eba, socio del brazo inversor en bioelectrónica de GSK, Action Potential Venture Capital. Eba calcula que la semilla inicial de GSK de 50 millones de dólares en Action Potential ha crecido hasta unos 200 millones de dólares (unos 184 millones de euros) en activos gestionados.
Ya se llame medicina bioelectrónica o electrocéutica, a algunos investigadores les gustaría que la definición adquiriera un alcance más amplio. "Ha sido un enfoque extremadamente neurocéntrico", afirma Daniel Cohen.
La neuroestimulación aún no ha demostrado su eficacia contra el cáncer. Sin embargo, otras formas de estimulación eléctrica han resultado sorprendentemente eficaces. En un estudio sobre el glioblastoma, los campos tratantes de tumores ofrecieron una versión eléctrica de la quimioterapia: un campo eléctrico bombardea un tumor cerebral, matando preferentemente solo las células cuya identidad eléctrica las marca como en división (lo que las células cancerosas hacen, patológicamente, pero las neuronas, al estar plenamente diferenciadas, no). Un estudio publicado recientemente en The Lancet Oncology sugiere que estos campos también podrían funcionar en el cáncer de pulmón para potenciar los fármacos existentes y prolongar la supervivencia.
Todo esto apunta a intervenciones más sofisticadas que estimular eléctricamente a un nervio. "Las cosas complejas que tenemos que hacer en medicina consistirán en comunicarnos con la toma de decisiones colectiva y la resolución de problemas de las células", afirma Michael Levin. Levin ha estado trabajando en la reconversión de fármacos ya aprobados para utilizarlos en la comunicación eléctrica entre células. En un giro curioso, ha optado por llamar a estos fármacos electrocéuticos, lo que ha irritado a algunos. Pero sin duda encontrará el apoyo de investigadores como Cohen. "Yo describiría los electrocéuticos de forma mucho más amplia como cualquier cosa que manipule la electrofisiología celular", afirma Cohen.
Incluso las intervenciones en el sistema nervioso podrían verse favorecidas por la ampliación de nuestros conocimientos sobre el modo en que las células nerviosas reaccionan a la electricidad, más allá de los potenciales de acción. Kim Gokoffski, profesor de oftalmología clínica de la Universidad del Sur de California (Los Ángeles, California, EE UU), trabaja con la galvanotaxis como posible medio de reparar daños en el nervio óptico. En experimentos anteriores en los que se regeneran axones —los cables que transportan los mensajes desde las neuronas—, estas nuevas fibras nerviosas tienden a no encontrar el objetivo al que deben volver a unirse. Los métodos actuales "pisan el acelerador", dice, "pero nadie controla el volante". Así que su grupo utiliza campos eléctricos para guiar a los axones en regeneración hasta su posición. En ensayos con roedores, ha funcionado lo bastante bien como para devolver parcialmente la vista.
Y sin embargo, dice Cohen, "hay un estigma social masivo en torno a esto que está obstaculizando significativamente todo el campo". Ese estigma ha condicionado drásticamente la dirección y la financiación de la investigación. En el caso de Gokoffski, ha dificultado la publicación. También recuerda que un alto funcionario de los NIH calificó de "New Age" el trabajo de su laboratorio para reconectar los nervios ópticos. Fue una sorpresa desagradable: "Tiene una connotación muy mala".
Sin embargo, hay indicios de un mayor apoyo al trabajo fuera del modelo neurocéntrico de la medicina bioeléctrica. El Departamento de Defensa de Estados Unidos financia proyectos de curación eléctrica de heridas (entre ellos el de Gokoffski). El cometido original de Action Potential, limitado a la estimulación eléctrica de los nervios periféricos, se ha ampliado. "Ahora tenemos un enfoque más amplio, en el que la energía (en cualquier forma, ya sea eléctrica, electromagnética o acústica) puede dirigirse a regular las actividades neuronales u otras actividades celulares del cuerpo", escribió Eba en un correo electrónico. Tres de las empresas que tienen ahora en cartera se centran en áreas ajenas a la neuroestimulación. "Aunque no tenemos ninguna inversión dirigida específicamente a la cicatrización de heridas o la medicina regenerativa, para nosotros no hay ninguna exclusión explícita", afirma.
Esto sugiere que el "estigma social" descrito por Cohen en torno a la medicina eléctrica fuera del sistema nervioso está empezando a remitir lentamente. Pero para que estos proyectos prosperen de verdad, es necesario apoyar el campo, no solo tolerarlo, quizá con su propia hoja de ruta y un programa específico de los NIH. Independientemente de que la medicina bioeléctrica acabe siguiendo o no la hoja de ruta original de los electrocéuticos, SPARC ha garantizado el florecimiento de una comunidad investigadora que persigue con ahínco alternativas prometedoras.
El uso de la electricidad fuera del sistema nervioso necesita un programa SPARC propio. Pero si la historia sirve de guía, lo primero que necesita es un nombre pegadizo. No puede ser "electrocéuticos". Y los investigadores deberían consultar los listados de marcas antes de ponerlo en marcha.
Sally Adee es escritora de ciencia y tecnología y autora de 'We Are Electric: Inside the 200-Year Hunt for Our Body's Bioelectric Code, and What the Future Holds'.


