
Biotecnología
La emprendedora que quiere fabricar órganos para salvar a su hija y otras muchas vidas
Martine Rothblatt cree que llegará el día en el que los órganos trasplantables y los impresos en 3D estarán fácilmente disponibles, salvando innumerables vidas, incluida la de su hija
Los órganos a la carta son una de las 10 Tecnologías Emergentes de MIT Technology Review para 2023. Explora el resto de la lista aquí.
Conocí a la empresaria Martine Rothblatt en una reunión en West Point en 2015 en la que se estudiaba cómo la tecnología podría ampliar la oferta de órganos para trasplantes. La lista de espera para trasplantes en Estados Unidos ha llegado a alcanzar las 100.000 personas en algunos momentos e, incluso con un récord de 41.356 trasplantes el año pasado, 6.897 personas murieron mientras esperaban. Otros miles de pacientes nunca llegaron a entrar en la lista.
Rothblatt llegó a West Point en helicóptero, sobrevolando el río Hudson. Fue una llegada digna de una presidenta, pero también me hizo pensar en la entrega de un órgano empaquetado en hielo seco, que llegara a algún lugar justo a tiempo para salvar la vida de una persona. Más tarde me enteré de que Rothblatt, una experimentada piloto con un récord Guinness por una de sus hazañas de vuelo estaba ella misma a los mandos.
La dramática historia personal de Rothblatt ya era bien conocida. Había sido una exitosa empresaria de satélites, pero después de que a su hija Jenesis le diagnosticaran una enfermedad pulmonar mortal, había creado una empresa de biotecnología, United Therapeutics. Fármacos como el desarrollado por United mantienen con vida a muchos pacientes como Jenesis. Pero con el tiempo podría necesitar un trasplante de pulmón. Por eso Rothblatt se propuso resolver también ese problema, utilizando la tecnología para crear lo que ella llama un "suministro ilimitado de órganos trasplantables".

Foto: La abogada y empresaria Martine Rothblatt en una foto de 2014. Créditos: PETER HAPAK/ARCHIVO TRUNK.
La empresaria explicó sus planes con la ayuda de una representación arquitectónica de una granja de órganos situada sobre un exuberante césped verde, con sus secciones en forma de tubo conectadas caprichosamente siguiendo un patrón de copos de nieve. Los tejados estaban salpicados de paneles solares y había plataformas de aterrizaje para drones eléctricos. La estructura albergaría una piara de mil cerdos modificados genéticamente, que vivirían en estrictas condiciones libres de gérmenes. Habría un quirófano y veterinarios que dormirían a los cerdos antes de extirparles el corazón, los riñones y los pulmones. Estos órganos vitales -diseñados para ser compatibles con los cuerpos humanos- se cargarían en helicópteros eléctricos y se transportarían a los centros de trasplantes.
Por aquel entonces, la visión de Rothblatt no sólo parecía imposible, sino "fantasmagórica", como ella misma la ha calificado. Pero en el último año se ha acercado varios pasos a la realidad. En septiembre de 2021, un cirujano de Nueva York conectó un riñón de un cerdo modificado genéticamente por la empresa de Rothblatt a una persona con muerte cerebral, en un experimento para ver si el riñón sobrevivía. Y sobrevivió. Desde entonces, los médicos estadounidenses han intentado otros seis trasplantes de cerdo a humano.
El más espectacular de ellos, y el único en una persona viva, fue un caso de 2022 en Maryland, en el que un hombre de 57 años con insuficiencia cardíaca vivió dos meses con un corazón de cerdo suministrado por la empresa de Rothblatt. El cirujano, Bartley Griffith, dijo que era "bastante asombroso" poder conversar con un hombre con un corazón de cerdo latiendo en su pecho. El paciente acabó muriendo, pero el experimento demostró que se trataba del primer trasplante de órganos de cerdo a humano. Según United, los ensayos formales con órganos de cerdo podrían ponerse en marcha en 2024.
En el centro de todo esto está Rothblatt, una abogada con un doctorado en ética médica a la que la revista New York apodó “directora ejecutiva de todo lo trans". No es sólo porque cambiara de sexo masculino a femenino en la madurez, como escribe en su libro From Transgender to Transhuman (De transgénero a transhumana). También es una prolífica filósofa sobre la ética del futuro que ha defendido los derechos civiles de los programas informáticos, ha comparado la división tradicional de sexos con el apartheid racial y ha fundado una religión transhumanista, Terasem, que sostiene que "la muerte es opcional y Dios es tecnológico". Es una franca defensora de la inmortalidad humana, ya se consiga creando versiones informáticas de personas vivas o, tal vez, sustituyendo sus órganos a medida que envejecen.
Desde que los trasplantes de órganos porcinos acapararon los titulares de primera plana, Rothblatt ha estado de gira por reuniones médicas, subiendo al estrado para describir su trabajo. Pero ha rechazado las llamadas de los periodistas, incluida la mía. El motivo: "Me prometí a mí misma no conceder más entrevistas hasta que lograra algo que me pareciera digno de ello", escribió en un correo electrónico. Incluía una lista de los nuevos éxitos a los que aspiraba. Por ejemplo, mantener un corazón de cerdo latiendo durante tres meses en un paciente, salvar la vida de una persona con un riñón de cerdo o mantener con vida a cualquier animal con un pulmón impreso en 3D, otra tecnología que United está desarrollando.
El siguiente gran paso para los órganos porcinos será un ensayo clínico organizado que demuestre que salvan vidas de forma sistemática. United y dos competidores, eGenesis y Makana Therapeutics, que tienen sus propios cerdos, están consultando a la Administración de Alimentos y Medicamentos de EE UU sobre cómo realizar un ensayo de este tipo. Es probable que los trasplantes de riñón sean los primeros.
"Muchas personas no están en la lista debido a la escasez de órganos. Sólo los pacientes más idóneos entran en la lista".
Robert Montgomery
Antes de que puedan iniciarse los ensayos más amplios en humanos, dicen las empresas y los médicos, la FDA les pide que realicen una serie de experimentos en monos. La agencia busca una supervivencia "consistente" de los animales durante seis meses o más, y exige que los cerdos se críen en instalaciones especiales libres de gérmenes. "Si no se cumplen estas dos condiciones, será difícil empezar", explica Joseph Tector, cirujano de la Universidad de Miami y fundador de Makana.
No está claro qué empresa u hospital iniciará primero un ensayo. Tector dice que el ambiente de competencia se mantiene a raya por el riesgo de errores. Sólo dos o tres trasplantes fallidos podrían condenar al fracaso un programa. "¿Queremos hacer el primer ensayo? Claro que sí. Pero es muy, muy importante que no tratemos esto como una carrera. No es la Copa América", afirma.
Pese a que podría haber sucedido lo opuesto, los principales centros de trasplantes están compitiendo por formar parte de las pruebas y contribuir a hacer historia. "¿Quiénes serán los astronautas? Creemos que va a funcionar y que va a cambiarlo todo", dice Robert Montgomery, el cirujano de la Universidad de Nueva York que llevó a cabo el primer trasplante de un riñón de cerdo.
Y no porque los órganos porcinos vayan a sustituir a los trasplantes entre humanos. Éstos funcionan tan bien -los trasplantes de riñón tienen éxito el 98% de las veces y suelen durar 10 o 20 años- que es casi seguro que los órganos porcinos no serán tan buenos. La diferencia es que, si realmente se dispone de "órganos ilimitados", aumentará enormemente el número de personas que podrían optar a ellos, lo que desvelará necesidades actualmente enmascaradas por estrictas normas y procedimientos de trasplante.
"Muchas personas no están en la lista por la escasez de órganos. Sólo se incluye en la lista a los pacientes más idóneos, los que tienen más probabilidades de salir bien", dice Montgomery. "Existe un procedimiento de selección. No hablamos mucho de ello, pero si hubiera órganos ilimitados, se podría sustituir la diálisis, los dispositivos de asistencia cardiaca e incluso los medicamentos que no funcionan tan bien. Creo que hay un millón de personas con insuficiencia cardíaca, ¿y cuántas reciben un trasplante? Sólo 3.500".
Una hija enferma
Antes de convertirse en empresaria biotecnológica, Rothblatt había creado una empresa de satélites. Fue una de las primeras en ver que con un satélite lo bastante potente en órbita estacionaria sobre la Tierra, gracias al cual los receptores podrían reducirse al tamaño de una carta, una idea que se convirtió en SiriusXM Radio. Pero sus planes dieron un giro a principios de los 90, cuando a su hija pequeña le diagnosticaron hipertensión arterial pulmonar. Se trata de una enfermedad rara en la que la presión en la arteria entre los pulmones y el corazón es demasiado alta. Es mortal en pocos años.

Foto: Rothblatt fundó una empresa de biotecnología, United Therapeutics, tras enterarse de que su hija Jenesis (en la foto del fondo) padecía una enfermedad pulmonar mortal. Créditos: AP PHOTO/JACQUELYN MARTIN.
"Teníamos un problema: me iba a morir", recordó, durante un discurso en 2017, Jenesis, quien ahora trabaja para United como jefa de proyecto.
Rothblatt y su esposa se sorprendieron cuando los médicos dijeron que no había cura. Rothblatt ha definido sus sentimientos de entonces como ver todo negro o rodar por el suelo encogida por un dolor insoportable. Pero en lugar de rendirse, empezó a atacar el problema. Se escapaba de la UCI donde estaba su hija y visitaba la biblioteca del hospital, leyendo todo lo que podía sobre la enfermedad, según recuerda.
Finalmente, leyó sobre un medicamento que podía reducir la presión arterial, pero que había sido abandonado por el gigante farmacéutico Glaxo. Acosó a la empresa hasta que se lo vendieron por 25.000 dólares (23.090 euros) y la promesa de un 10% de regalías, recuerda. Rothblatt, según explica, recibió a cambio una bolsa del producto químico, una patente y un documento que aseguraba que el fármaco nunca funcionaría.
El fármaco, treprostinil sódico, funcionó y fue aprobado en 2002. Cabría esperar que, con sólo unos pocos miles de pacientes afectados por la enfermedad, nunca fuera rentable. Sin embargo, una vez que el fármaco estuvo disponible y los pacientes empezaron a vivir, en lugar de morir, necesitaron seguir tomándolo. La familia de este fármaco genera ahora 1.500 millones de dólares (1.385 millones de euros) en ventas cada año para United.
Sin embargo, aunque estos fármacos funcionan bien para aliviar los síntomas, los pacientes pueden acabar necesitando nuevos pulmones. Rothblatt comprendió desde el principio que los fármacos eran sólo un puente que prolongaba la vida hasta un trasplante de pulmón. Pero no hay pulmones humanos suficientes para ayudar a todo el mundo. Y ése era el verdadero problema.
El lugar más obvio para obtener muchos órganos eran los animales, pero en aquel momento el "xenotrasplante" -traslado de órganos entre especies- no parecía tener buenas perspectivas. Las pruebas demostraban que el sistema inmunitario humano destruía ferozmente los órganos procedentes de cerdos; este rechazo "hiperagudo" se produce en cuestión de minutos u horas. En Estados Unidos, algunos científicos pidieron una moratoria ante el pánico de la opinión pública por si un virus porcino pudiera saltar a los humanos y causar una pandemia.
En 2011, United Therapeutics pagó 7,6 millones de dólares (7 millones de euros) para comprar Revivicor, una empresa de biotecnología en dificultades que, bajo su nombre anterior PPL Therapeutics, había financiado la clonación de la oveja Dolly por el científico escocés Ian Wilmut en 1996. Mediante técnicas de clonación, Revivicor ya había producido cerdos que carecían de una molécula de azúcar, alfa-gal, cuya presencia en cualquier parte de los órganos porcinos se sabía que provocaba el rechazo del órgano en cuestión de minutos. Ahora Rothblatt convocó a expertos para dar prioridad a otros ocho o doce genes para modificar y emprender "un moonshot [un disparo a la Luna, metáfora de un salto tecnológico] para editar genes adicionales, hasta que tengamos un animal que pueda proporcionarnos órganos tolerables". Se dio un plazo de 10 años para lograrlo, teniendo en cuenta que el tiempo se agotaba para pacientes como Jenesis.
Llegar a los humanos
El año pasado, United había elaborado una lista de 10 modificaciones genéticas. Tres de ellas eran los llamados genes knockouts, genes porcinos eliminados del genoma para evitar que generasen las moléculas que alarman al sistema inmunitario humano. Otros seis eran genes humanos añadidos, que dotarían al órgano de una especie de capa protectora para disimular las diferencias entre los sistemas inmunitarios humano y porcino, desarrolladas desde que los homínidos y los cerdos se nos separaron de un ancestro común, hace entre 80 y 100 millones de años. Todavía quedaba un toque final: desactivar un receptor que detecta la hormona del crecimiento, ya que los cerdos son más grandes que nosotros y este cambio impediría que el órgano creciera demasiado.
Rothblatt comprendió desde el principio que los fármacos eran sólo un puente para prolongar la vida hasta un trasplante de pulmón.
Los órganos con estas modificaciones, especialmente cuando se combinan con nuevos tipos de fármacos inmunosupresores, han dado buenos resultados en monos. "Creo que las modificaciones genéticas que han hecho en estos órganos han sido increíbles. Le diré que tenemos primates que llevan un año con un riñón [de cerdo] con buena función", explica Leonardo Riella, director de trasplantes renales del Hospital General de Massachusetts, en Boston.
En 2021, algunos cirujanos de trasplantes ya estaban listos para probar los órganos en humanos, al igual que Rothblatt. El obstáculo era que, antes de dar luz verde a un ensayo formal en humanos, la FDA, en una reunión celebrada ese mismo otoño, había pedido una serie adicional de experimentos con monos en los que se fijaran y estandarizaran todos los procedimientos, fármacos y pruebas previstos. La FDA también quería pruebas consistentes de que los órganos sobreviven mucho tiempo en los monos: medio año o más, según personas informadas por la agencia.
Cada experimento costó 750.000 dólares (692.790 euros), según Griffith, cirujano de trasplantes de la Universidad de Maryland, y algunos médicos pensaron que los monos ya no podían decirles mucho más. "Salimos de aquella reunión [pensando]: '¿Significa eso que estamos condenados durante los próximos dos años a seguir haciendo lo que estábamos haciendo?". recuerda Griffith. Lo que realmente necesitaban ver era cómo se comportaban los órganos en un ser humano, una pregunta que más monos no responderían. "Sabíamos que no habíamos aprendido lo suficiente", afirma.
Montgomery, el cirujano de la NYU, recuerda una conversación de horas con Rothblatt tras la cual United acordó que podría probar un riñón en una persona con muerte cerebral a la que se mantenía viva con un respirador. Como el individuo estaba muerto, no se necesitaría la aprobación de la FDA. "El problema es que un xenoinjerto es mucho más complejo que un fármaco. Y ése ha sido su talón de Aquiles. Por eso se ha mantenido en modelos animales", afirma. "Así que este fue un intento de hacer un paso intermedio para llevarlo a la especie diana". La operación tuvo lugar en septiembre de 2021 y el órgano estuvo unido al sujeto sólo 54 horas.
En Maryland, Griffith, cirujano cardíaco, concibió una estrategia diferente. Pidió a la FDA que aprobara un estudio de "uso compasivo", básicamente un intento desesperado de salvar una vida. Para su sorpresa, la agencia accedió, y a principios de 2022 trasplantó un corazón de cerdo en el pecho de David Bennett Sr., un hombre con insuficiencia cardiaca avanzada que no reunía los requisitos para un trasplante de corazón humano. Según Rothblatt, Bennett fue entrevistado por cuatro psicólogos antes de someterse a la operación.
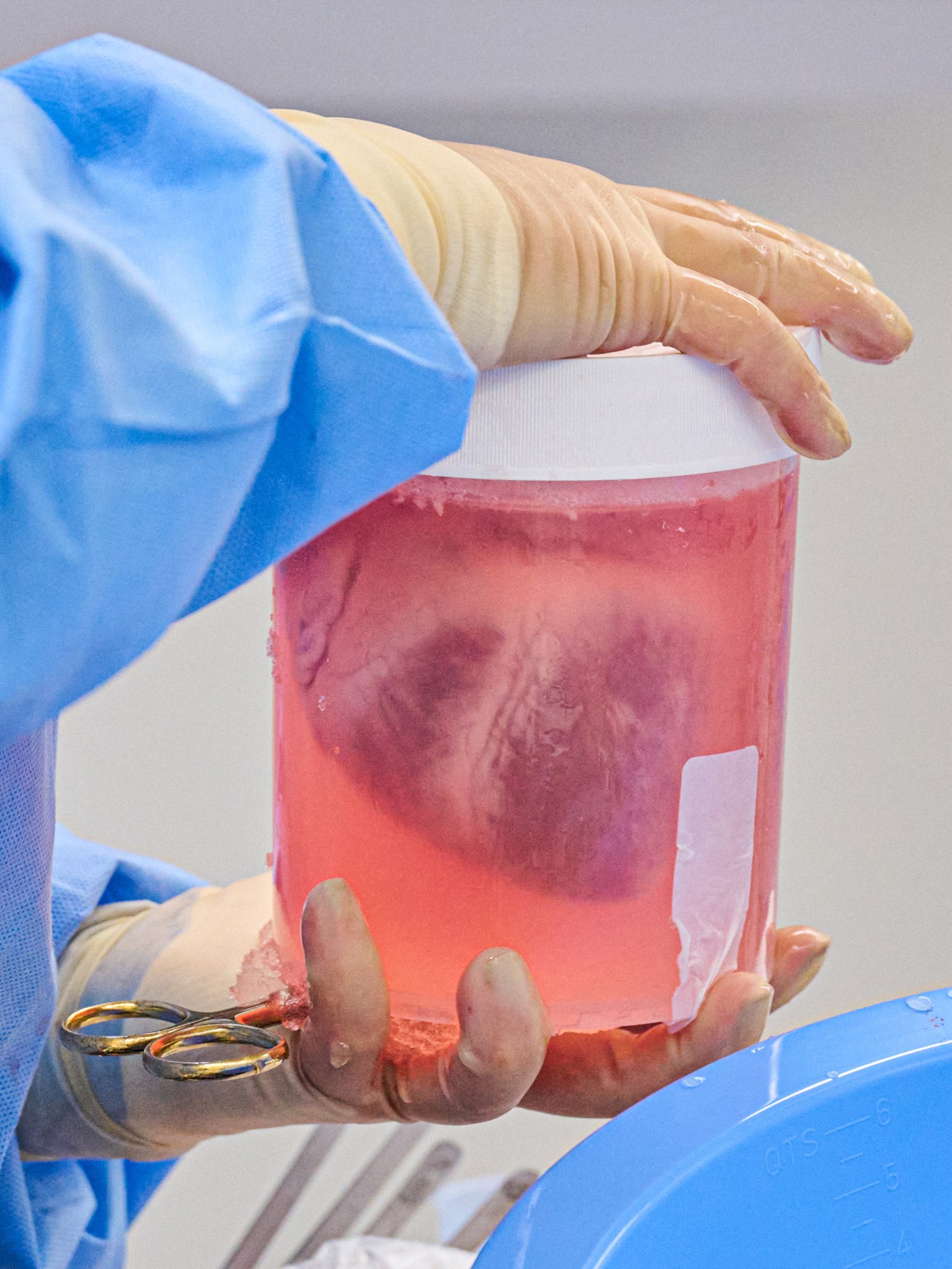
Foto: Un corazón de cerdo modificado genéticamente se prepara para el trasplante en la Universidad de Nueva York en julio de 2022. Créditos: JOE CARROTTA/NYU LANGONE HEALTH.
Para observadores como Arthur Caplan, bioeticista de la Universidad de Nueva York, el uso de trasplantes puntuales para obtener información plantea una cuestión ética. "Entonces, ¿piensas: 'Este tipo está moribundo; quizá podamos aprender algo'? Pero el tipo está pensando: 'Quizá pueda sobrevivir y conseguir un puente hacia un corazón humano'. Creo que se está llevando a cabo una especie de experimento por la puerta de atrás", opina Caplan.
Bennett sobrevivió dos meses antes de que su nuevo corazón dejara de funcionar, lo que le convirtió en la primera persona del mundo en recibir un trasplante vital de un cerdo modificado genéticamente. Para Rothblatt, eso significaba el éxito: incluso en la autopsia, no había signos evidentes de que el órgano hubiera sido rechazado, exactamente el resultado por el que ella había estado trabajando. "No hay forma de saber si habríamos podido hacer un corazón mejor en el tiempo previsto... [pero] este corazón de 10 genes pareció funcionar muy bien", dijo a un grupo de médicos el pasado mes de abril. En opinión de Griffith, el órgano funcionó como una "estrella del rock".
Pero al final Bennett murió. Y, en sus conferencias, Rothblatt ha eludido un grave error, uno que algunos médicos sospechan que fue lo que realmente mató al paciente. Cuando Bennett aún vivía en el hospital, los investigadores que controlaban su sangre descubrieron que el corazón trasplantado estaba infectado por un virus porcino. Este germen, llamado citomegalovirus, es bien conocido por provocar el fracaso de los trasplantes. El equipo de Maryland podría haber perjudicado aún más las posibilidades de Bennett al luchar contra la infección, cambiándole los fármacos y administrándole plasma.
Sin el virus, ¿habría seguido latiendo el corazón? Lo más cerca que Rothblatt ha estado de reconocer el problema en público fue cuando le dijo a un comité jurídico de la Academia Nacional de Ciencias que ella no echaba la culpa al corazón de cerdo. "Si tuviera que explicarlo en términos sencillos, diría que el corazón no fue lo que le falló al paciente", afirmó.
El mayor problema de la infección, y del hecho de que Rothblatt no asumiera el error, es que se suponía que los cerdos de United habían sido sometidos a pruebas y estaban libres de gérmenes. El silencio de United es desconcertante, porque si este virus pudo colarse, es posible que también lo hicieran otros gérmenes más dañinos. Rothblatt no respondió a nuestras preguntas sobre el virus.
Pulmones impresos
United afirma que está construyendo unas nuevas instalaciones porcinas a prueba de gérmenes, que estarán listas en 2023 y permitirán realizar un ensayo clínico a partir del año siguiente. No es la fantástica fábrica comercial de cerdos que se muestra en la representación arquitectónica de Rothblatt, pero es un paso hacia ella. Rothblatt cree que, con el tiempo, una única instalación podría suministrar órganos a todo el país en ambulancias aéreas totalmente eléctricas. Afirma que este verano una empresa aeronáutica en la que invirtió, Beta Technologies, hizo volar un avión eléctrico de elevación vertical desde Carolina del Norte hasta Arkansas, más de 1.000 millas náuticas.
Irónicamente, puede que los cerdos nunca sean una fuente de los pulmones que puede necesitar la hija de Rothblatt. Esto se debe a que los pulmones son delicados y más susceptibles al ataque inmunológico. En 2018, los resultados eran cada vez más claros. Cada vez que la compañía añadía una nueva edición genética a los cerdos, los corazones y riñones trasplantados a los monos duraban unas semanas o meses más. Pero los pulmones no mejoraban. Una y otra vez, tras ser trasplantados a monos, los pulmones de los cerdos duraban dos semanas y de repente fallaban.
"En realidad, no creo que haya ninguna parte del cuerpo que no pueda imprimirse en 3D".
Martine Rothblatt
Para crear pulmones, Rothblatt apuesta por un enfoque diferente, creando una empresa de "fabricación de órganos" que intenta fabricar pulmones con impresoras 3D. Esta empresa funciona actualmente en una antigua fábrica textil de Manchester (New Hampshire), donde los investigadores imprimen modelos detallados de pulmones a partir de biopolímeros. La idea final es sembrar estas estructuras con células humanas, incluidas (en una versión de la tecnología) células cultivadas a partir del tejido de pacientes concretos. Serían compatibles a la perfección, sin riesgo de rechazo inmunitario.
La pasada primavera, Rothblatt presentó un conjunto de "pulmones" impresos que calificó como "el objeto impreso en 3D más complejo de cualquier tipo jamás creado en cualquier lugar". Según United, la esponjosa estructura, del tamaño de un balón de fútbol, incluye 4.000 kilómetros de canales capilares, espacios detallados que imitan los sacos pulmonares y un total de 44 billones de vóxeles o píxeles tridimensionales indiviuales impresos. La impresión se realizó con un método llamado procesamiento digital de la luz, que funciona apuntando un proyector a una cuba de polímero que se solidifica donde tocan los haces de luz. Se tarda un tiempo -tres semanas- en imprimir una estructura tan detallada, pero el método permite crear cualquier forma, algunas no más grandes que una sola célula. Rothblatt comparó la precisión del proceso de impresión con conducir a través de Estados Unidos y no desviarse más que la anchura de un cabello humano de la línea central.

Ilustración: MICHAEL BYERS
"De hecho, no creo que haya ninguna parte del cuerpo que no pueda imprimirse en 3D... incluidos el colon y el tejido cerebral", dijo Rothblatt al presentar los andamios pulmonares impresos en junio en una reunión en California.
Algunos científicos afirman que la bioimpresión sigue siendo un proyecto de investigación y se preguntan si los polímeros sin vida, por muy detallados que sean, deben compararse con un órgano real. "De ahí a un pulmón hay un largo trecho", dice Jennifer Lewis, que trabaja con bioimpresión en la Universidad de Harvard. "No quiero aguar la fiesta, y ha habido una inversión significativa, por lo que algunas mentes inteligentes ven algo ahí. Pero desde mi punto de vista, se ha exagerado bastante. De nuevo, es un andamio. Tiene una forma preciosa, pero no es un pulmón". Lewis y otros investigadores se preguntan hasta qué punto será factible insuflar vida real a las estructuras impresas. Introducir células humanas en un andamio no garantiza que se organicen en un tejido funcional con las complejas funciones de un pulmón.
Rothblatt es consciente de los escépticos y sabe lo difícil que es esta tecnología. Sabe que otros piensan que nunca funcionará. Pero eso no la detiene. Lo ve como su próxima oportunidad de resolver problemas que otros no pueden resolver. En un discurso dirigido a cirujanos este año, Rothblatt enumeró la lista de retos que tiene por delante, incluido el cultivo de los billones de células que se necesitarán. "Lo que sí sé es que hacerlo no viola ninguna ley de la física", dijo, y predijo que los primeros pulmones fabricados se colocarían en la cavidad torácica de una persona esta década.
Cerró su charla con una escena de 2001: Odisea del espacio, aquella en la que un hombre mono lanza un hueso hacia arriba y éste levanta el vuelo como una estación espacial que da vueltas alrededor de la Tierra. Salvo que Rothblatt la sustituyó por una fotografía de sí misma, pilotando el avión eléctrico sin emisiones de carbono que cree que algún día repartirá órganos ilimitados por todo el país.


