Hay una encarnizada pelea en marcha por las patentes para CRISPR, una técnica muy prometedora de edición del ADN
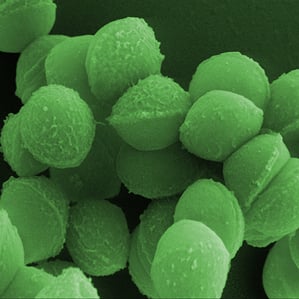 Foto: Estas bacterias 'Streptococcus pyogenes' usan una defensa que consiste en cortar el ADN de los virus invasores. El sistema, conocido como CRISPR, se está intentando desarrollar para tratar enfermedades genéticas humanas.
Foto: Estas bacterias 'Streptococcus pyogenes' usan una defensa que consiste en cortar el ADN de los virus invasores. El sistema, conocido como CRISPR, se está intentando desarrollar para tratar enfermedades genéticas humanas.
El mes pasado en Silicon Valley (EEUU), las biólogas Jennifer Doudna y Emmanuelle Charpentier se presentaron con elegantes vestidos negros a la entrega del Premio Breakthrough por valor de 3 millones de dólares (unos 2,4 millones de euros), un llamativo galardón que otorgan multimillonarios de internet, entre ellos Mark Zuckerberg. Lo habían ganado por desarrollar CRISPR-Cas9, una "potente tecnología general" para editar el genoma que se considera un importante avance en la biotecnología.
Aquella noche el que no se puso de tiros largos fue Feng Zhang, investigador en el Instituto Broad del Instituto de Tecnología de Massachusetts y la Universidad de Harvard de Cambridge (ambos EEUU). Pero Zhang ya había conseguido su propia recompensa. En abril obtuvo una patente general en Estados Unidos sobre CRISPR-Cas9 que le da a él y a su centro de investigación control sobre casi todos los usos comerciales importantes de la tecnología.
¿Cómo puede ser que el premio para CRISPR y su patente correspondiente acabaran en manos distintas? Es la pregunta en la que se centra la acalorada disputa sobre quién inventó qué y cuándo y en la que están enzarzadas tres start-up con muchísima financiación, media decena de universidades y miles de páginas de documentos legales.
"La propiedad intelectual en este espacio es bastante compleja, para decirlo educadamente", afirma el antiguo ejecutivo de la industria farmacéutica Rodger Novak, que ahora es director ejecutivo de CRISPR Therapeutics, una start-up de Basilea (Suiza) cofundada por Charpentier. "Todo el mundo sabe que hay afirmaciones enfrentadas".
Aún no existe un medicamento CRISPR. Pero si CRISPR acaba siendo tan importante como esperan los científicos, el control comercial sobre la tecnología subyacente podría valer miles de millones.
En juego están los derechos sobre un invento que podría ser la nueva técnica de ingeniería genética más importante desde el principio de la era de la biotecnología en la década de 1970. El sistema CRISPR, que se conoce como la "función de buscar y reemplazar" para ADN, permite a los científicos inhabilitar fácilmente los genes y cambiar su función sustituyendo letras del ADN: durante los últimos meses los científicos han demostrado que se puede usar CRISPR para librar a los ratones de la distrofia muscular, curarlos de una rara enfermedad hepática, hacer que las células humanas sean inmunes al VIH y modificar genéticamente a unos monos (ver "Cirugía del genoma" y "TR10: Edición genómica").
El control de las patentes es clave para varias start-up que, en su conjunto han recaudado rápidamente más de 80 millones de dólares (unos 64 millones de euros) para convertir a CRISPR en terapias para enfermedades devastadoras. Entre ellas están Editas Medicine e Intellia Therapeutics, ambas de Cambridge. Las empresas esperan empezar con ensayos clínicos en apenas tres años.
Zhang cofundó Editas Medicine, y esta semana la start-up anunció que había comprado la licencia para el uso de su patente al Instituto Broad. Pero Editas no tiene el monopolio sobre CRISPR porque Doudna, bióloga estructural de la Universidad de California en Berkeley (EEUU), también fue cofundadora de la start-up. Y desde que salió la patente de Zhang, Doudna ha roto con la empresa, y su propiedad intelectual -en forma de su propia patente pendiente de aprobación- se ha vendido bajo licencia a Intellia, una start-up de la competencia desvelada hace apenas un mes. Para complicar aún más las cosas, Charpentier vendió sus derechos de la misma solicitud de patente a CRISPR Therapeutics.
En un correo electrónico, Doudna afirma que ya no tiene ninguna relación con Editas. "Ahora mismo ya no formo parte del equipo de la empresa", afirma. Doudna no quiso responder a otras preguntas, refiriéndose a la disputa sobre la patente.
Ahora mismo hay pocos investigadores dispuestos a comentar sobre la pelea de las patentes. No cabe duda de que se pondrán denuncias y les preocupa que cualquier cosa que puedan decir se use en su contra. "Esta tecnología ha creado mucha excitación y también mucha presión. ¿Qué vamos a hacer? ¿Qué clase de empresa queremos?", afirma Charpentier. "Todo suena muy confuso para alguien que no está metido y también lo es para los que estamos dentro".
Los laboratorios académicos no están esperando que se resuelvan las disputas sobre patentes, sino que se están dando prisa por montar grandes equipos de ingeniería para perfeccionar y mejorar la técnica de edición del genoma. En el campus de Boston de la Facultad de Medicina de la Universidad de Harvard (EEUU), por ejemplo, George Church, un especialista en tecnología genómica, afirma tener a 30 personas en su laboratorio dedicadas a esta tarea.
Según Zhang, debido a todas las nuevas investigaciones, la importancia de cualquier patente, incluyendo la suya, no está del todo clara. "Es una pieza importante, pero en realidad no presto atención a las patentes", afirma. "La forma final de esta tecnología, la que acabe cambiando la vida de la gente, puede ser muy distinta".
Este nuevo sistema de edición de los genes se descubrió primero en las bacterias, organismos que lo usan como una forma de identificar y después descomponer el ADN de los virus invasores. Ese trabajo se prolongó durante una década. Y en junio de 2012, un pequeño equipo dirigido por Doudna y Charpentier publicó un artículo clave demostrando cómo convertir esa maquinaria natural en una herramienta de edición "programable", que servía para cortar cualquier cadena de ADN, por lo menos en una probeta.
El siguiente paso estaba claro, los científicos tenían que ver si la herramienta mágica de edición servía para los genomas de las células humanas. En enero de 2013 los laboratorios de Church en Harvard y Zhang en Broad fueron los primeros en publicar artículos demostrando que la respuesta era sí. Doudna publicó sus propios resultados apenas unas semanas más tarde.
Para entonces todo el mundo se había dado cuenta de que CRISPR podría convertirse en una forma tremendamente flexible de reescribir el ADN y posiblemente de tratar enfermedades genéticas que iban desde la hemofilia hasta los problemas metabólicos raros pasando por enfermedades neurodegenerativas como la de Huntington.
Rápidamente, los grupos de inversión de capital riesgo empezaron a reclutar a los científicos clave detrás de CRISPR, a atar las patentes y formar start-up. Charpentier se ligó a CRISPR Therapeutics en Europa. Doudna ya había montado una pequeña empresa. Caribou Biosciences, pero en 2013 se unió a Zhang y Church como cofundadora de Editas. Habiendo recibido 43 millones de dólares (unos 34 millones de euros) de los fondos de inversión Third Rock Ventures (ver "Puesto 8: Third Rock es el mejor capital de riesgo para biotecnología"), Polaris Partners y Flagship Ventures, Editas parecía el dream-team de las start-up de edición genética.
En abril de este año Zhang y el Instituto Broad obtuvieron la primera de entre varias patentes generales que cubren el uso de CRISPR en eucariotas, o cualquier especie cuyas células contengan un núcleo. Eso significa que tenían los derechos para usar CRISPR en ratones, cerdos, ganado vacuno, humanos, en esencia en cualquier criatura que no fuera una bacteria.
La patente sorprendió a algunos. Y fue porque el Instituto Broad había pagado extra para que la revisaran muy rápido, en menos de seis meses, y pocos estaban enterados de que se estaba haciendo. Junto con la patente llegaron más de mil páginas de documentos. Según Zhang, la predicción de Doudna en su propia solicitud de patente (presentada antes que la de Zhang) de que su descubrimiento funcionaría en humanos era una "mera conjetura" y que en cambio él fue el primero en demostrarlo en un acto de invención distinto y "sorprendente".
Los documentos de la patente han causado consternación. La literatura científica demuestra que varios científicos consiguieron que CRISPR funcionara en células humanas. De hecho, la facilidad para reproducir la técnica en distintos organismos es el hito más emocionante de la tecnología. Algo que sugiere que, en términos de patentes, era "evidente" que CRISPR funcionaría en células humanas y que la invención de Zhang quizá no merezca su propia patente.
Es más, la credibilidad científica está en juego. Para demostrar que fue "el primero en inventar" el uso de CRISPR-Cas en células humanas, Zhang presentó fotos de cuadernos de laboratorio que según él demuestran que tenía el sistema en marcha a principios de 2012, incluso antes de que Doudna y Charpentier publicaran sus resultados o solicitaran su propia patente. Esa cronología significaría que él descubrió el sistema CRISPR-Cas independientemente. En una entrevista, Zhang afirmó que había hecho los descubrimientos él solo. Al preguntársele qué había aprendido del artículo de Doudna y Charpentier, dijo "no mucho".
No todo el mundo está convencido. "Yo sólo puedo decir que lo hicimos en mi laboratorio con Jennifer Doudna", afirma Charpentier, que ahora es profesora en el centro Helmholtz para Investigación en Infecciones y la facultad de medicina de Hannover (Alemania). "Todo en este caso está muy exagerado porque este es uno de esos casos únicos en los que hay una tecnología que la gente puede comprender muy fácilmente y está cambiando la vida de los investigadores. Las cosas están yendo muy rápido, quizá demasiado".
Pero este no es el final de la pelea por la patente. Aunque el instituto Broad se movió rápidamente, se espera que los abogados de Doudna y Charpentier monten un procedimiento de interferencia en Estados Unidos, que es un proceso legal en el que el ganador se lo lleva todo y en el que un inventor puede hacerse con la patente de otro. Quién gane dependerá de qué científico puede producir cuadernos de laboratorio, correos electrónicos o documentos con las fechas más antiguas.
"Tengo mucha confianza en que el futuro se aclare la situación", afirma Charpentier. "Y me gustaría creer que la historia va a acabar bien".


